名古屋大学(名大)、東京大学(東大)、理化学研究所(理研)、科学技術振興機構(JST)の4者は2月29日、高い耐光性と細胞膜透過性を兼ね備えたライブセルイメージング用近赤外蛍光標識剤の開発に成功したと共同で発表した。
同成果は、名大 トランスフォーマティブ生命分子研究所の多喜正泰特任准教授、同・山口茂弘教授、同・フロハンス・タマ教授(理研 計算科学研究センター チームリーダー兼任)、東大大学院 医学系研究科/東大大学院 理学系研究科の岡田康志教授(理研 生命機能科学研究センター チームリーダー兼任)らの共同研究チームによるもの。詳細は、独国化学会の刊行する機関学術誌の国際版「Angewandte Chemie International Edition」に掲載された。
近赤外光は生体への毒性が低く、かつ自家蛍光の影響も受けにくいため、生細胞の長時間イメージングに適しているという。また、多くの蛍光タンパク質や蛍光標識剤と波長域が重ならないことから、標的の多色染色にも有用だ。しかし、従来の近赤外蛍光色素は水溶性が乏しく、化学的に不安定なものが多いため、蛍光イメージングへの利用は少なかった。
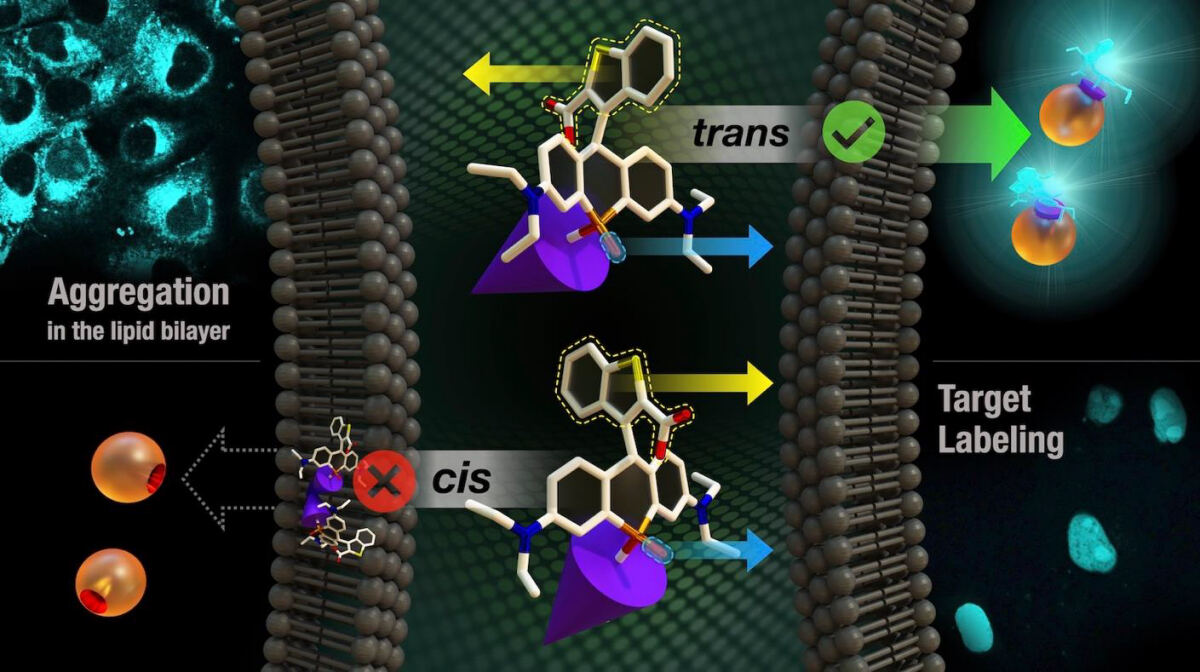
そうした中で研究チームは、それらの課題を解決するため、リン元素を含む電子受容性の原子団(ホスフィンオキシド)を、代表的な鮮紅色蛍光色素であるローダミン骨格に導入した近赤外蛍光色素「ホスファローダミン(POR)骨格」の開発を進めてきた。しかし、正の電荷を帯びたPORは細胞膜の透過性が低いため、任意のオルガネラの標識が難しいという課題があったとのこと。そこで今回の研究では、「2-カルボキシ-ベンゾ[b]チオフェン-3-イル(BT)基」を導入した近赤外色素を開発し、その課題の解決に挑んだとする。
BT基に導入されたカルボキシ基により、今回の近赤外色素は環が閉じた状態と開いた状態の平衡状態を取ることが可能だ。前者は電荷がないことから、細胞膜を透過しやすい構造となる。さらに、任意のオルガネラを蛍光標識するため、自己標識化タンパク質「HaloTag」と共有結合可能な「クロロアルカン」をリガンドとして導入したという。
BT基とPOR骨格は直交配置を取るため、今回の近赤外色素にはカルボキシ基とP=O基が同じ向きのシス型と、反対向きのトランス型が生じる。これらの立体異性体を分離し、HaloTagを融合させた核内タンパク質「ヒストンH2B」を発現させた細胞を用いて標識能を評価した結果、シス型では細胞内の膜組織が非特異的に染色されたのに対し、トランス型では核のみが特異的に標識される様子が確認されたとしている。
またトランス型は、HaloTagを小胞体やミトコンドリア、微小管などに発現させた細胞においても、各オルガネラを選択的に染色することに成功。細胞膜透過性を有する蛍光標識剤として機能することがわかった。そして近赤外光を用いることにより、細胞内のさまざまなオルガネラを同時に染色し、多色イメージングも容易に実現できるようになったという。
研究チームは次に、脂質二重膜内における各色素の振る舞いについて、分子動力学シミュレーションを行った。その結果、シス型は色素同士が相互作用し、脂質二重膜内で凝集体を形成しやすくなっていたとする。一方、トランス型は色素がリン脂質と相互作用することで、凝集体の形成が大幅に抑制されていることが判明。このような相互作用の違いが膜透過性の違いを引き起こすことは、蛍光標識剤開発における新たな知見とした。
続いて、トランス型の生細胞の蛍光イメージングへの応用が検証された。POR骨格は、光に対する安定性および化学的な安定性が高い上に、近赤外光で励起できることから、生理学的な条件での生細胞の動態を長時間にわたって観察可能だ。実際に、ヒストンH2Bの標識細胞において、90秒ごとに25時間かけて撮影でき、核分裂過程の追跡に成功したという。
優れた耐光性は超解像イメージングにおいても有効とする。そこで、スピニングディスク超解像顕微鏡法を用いて、細胞内の微細構造の3次元動態が追跡された。小胞体と微小管をそれぞれトランス型と市販の微小管標識剤で染色し、イメージ画像が異なる波長で同時かつ連続的に取得され、3次元+時間+波長の超解像5次元イメージングが実現された。これにより、小胞体膜と微小管の各ネットワークがどのように連結していくのかという動きを捉えることに成功したとする。
-

(a)生細胞オルガネラの多色イメージング。青:核、緑:リソソーム、黄:ミトコンドリア、赤:微小管、シアン:小胞体。(b)細胞構造の超解像3次元イメージング。赤:微小管(SiR-Tubulin)、シアン:小胞体(trans-1)。(c)経時的に変化する小胞体ネットワーク構造(出所:名大・JST共同プレスリリースPDF)
今回の研究成果により、細胞機能の理解や疾患メカニズムの解明など、医学や生命科学分野に画期的な進展をもたらすことが期待されるとのこと。さらに研究チームは、立体化学が膜透過性に深く関与しているのが突き止められたことを受け、この知見は薬物の膜透過性に関しても重要な情報であり、創薬開発への応用も見込まれるとしている。