名古屋市立大学(名市大)は9月8日、「がん悪液質」による筋萎縮を抑制する新たな分子機構を解明し、骨格筋が産生するタンパク質「p62」は抗酸化物質の発現を促進して、がん悪液質による筋萎縮を軽減することを解明したと発表した。
同成果は、名市大大学院 理学研究科の山田麻未研究員、同・奥津光晴准教授、筑波大学 医学医療系の蕨栄治准教授、名市大大学院 医学研究科の大石久史教授、米・アイオワ大学のVitor A Lira 准教授ら国際共同研究チームによるもの。詳細は、生物学と生物医学の全般を扱う学際的な学術誌「The FASEB Journal」に掲載された。
がん悪液質とは、がんに伴う体重(主に骨格筋)の減少や食欲不振を特徴とする症状のことをいう。がんによる酸化ストレスや炎症性サイトカインによってがん悪液質は促進され、筋萎縮が誘導される。がん患者における筋肉量の減少は、単なる身体活動の制限や代謝機能の悪化のみならず、QOLの低下や生存期間の短縮に関与することから、筋萎縮の発症と軽減の分子メカニズムを解明し、予防や治療に応用することは重要な課題となっている。
がん悪液質による筋萎縮は、酸化ストレスの増大による筋タンパク質の分解の促進が原因の1つであることから、抗酸化物質を増加し、酸化ストレスを抑制することで、筋萎縮の軽減が期待できるという。骨格筋が産生する抗酸化物質は、酸化ストレスを軽減し、筋萎縮の予防に貢献することが以前より報告されていた。抗酸化物質の産生は、細胞のストレス応答タンパク質である「Nrf2/NF-E2-related factor 2」(Nrf2)の核内移行の促進が、その代表的な機序として知られている。しかし、骨格筋のNrf2の核内移行を制御する分子機構は明らかではなかったという。
そこで研究チームは今回、細胞内に発現する「p62」に着目したとのこと。p62はタンパク質分解機構であるオートファジーを調節するタンパク質として広く知られる。さらに近年の研究により、オートファジータンパク質以外のさまざまなタンパク質と結合したり、タンパク質を修飾したりすることが報告されている。ただし、骨格筋の抗酸化物質を産生する分子機構と筋萎縮の抑制に対する役割は、まだ十分には解明されていなかったことから、今回の研究では、その解明を試みたとする。
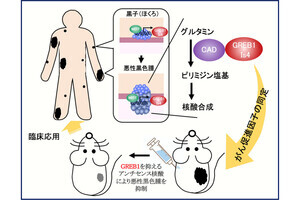
悪性細胞を用いた研究では、リン酸化したp62が「Keap1/Kelch-like ECH-associated protein 1」(Keap1)に選択的に結合することで、Keap1へのNrf2の結合を阻害し、Nrf2の核内移行を促進して抗酸化物質の産生を制御することが報告されていた。そこで今回は、p62の発現を筋特異的に増強したマウスを作成し、抗酸化物質の発現の検討が行われた。その結果、骨格筋のp62の発現増強はNrf2の核内移行を促進し、「CuZnSOD」や「EcSOD」などの抗酸化物質の発現を増加させることが発見されたとしている。
-

今回の研究の成果。がん悪液質は酸化ストレス(ROS:活性酸素種)を増大し筋萎縮を誘導する。骨格筋のp62の発現増加はp62のKeap1への結合することでNrf2の核内移行を活性化し、抗酸化物質の産生を促進することでがん悪液質による筋萎縮を軽減する。(出所:名市大プレスリリースPDF)
さらに、p62によるNrf2の核内移行の重要性を立証するため、作成した筋特異的p62発現増強マウスのNrf2を筋特異的に欠損したところ、p62の発現増強によるこれらの抗酸化物質の増加は消失したとのこと。これは、骨格筋のp62がNrf2を活性化することで、抗酸化物質の産生を調節することを示唆しているという。
さらに、p62の発現増強による筋萎縮予防効果を検討するため、筋特異的p62発現増強マウスにがん細胞が皮下投与され、筋萎縮の抑制効果が検討された。その結果、骨格筋のp62の発現を増強すると、酸化ストレスと筋タンパク質の分解が抑制され、がん悪液質による筋萎縮が軽減された。研究チームはこれらの結果から、骨格筋のp62の発現を調節することでがん悪液質を軽減し、骨格筋量を維持できる可能性を示唆しているとする。
今回の研究では、骨格筋の抗酸化物質の産生機構とその生理学的な役割が立証されたとしたうえで、骨格筋生物学を基盤とした基礎研究の成果を、医学や健康科学に応用する可能性が期待できるとしている。