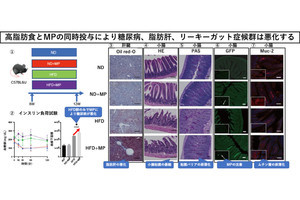
実験の結果、通常マウスをGAN食で飼育したところ、通常食で飼育した場合と比べて、肝臓において炎症や線維化に関わる遺伝子の量が増加したとのこと。同様に、脂肪組織インスリン抵抗性マウスにGAN食を投与したところ、通常マウスをGAN食で飼育した場合と比べ、肝臓の炎症や線維化に関わる遺伝子の量がさらに増加し、NASHがより進行したという。このことから、脂肪組織のインスリン抵抗性は、高脂肪・高コレステロール・高フルクトース食によって誘導される炎症と線維化をさらに悪化させることにより、肝病変を進展させることが明らかとなった。
また、GAN食を摂取した脂肪組織インスリン抵抗性マウスは肥満状態を伴わないことから、脂肪組織インスリン抵抗性は、アジア人で多く報告されている肥満を伴わない痩せ型のNASHの原因に関連するものと考えられるとしている。
インスリンは本来、脂肪組織において余剰な栄養を脂肪として蓄える働きがあるが、脂肪組織でインスリン抵抗性があると、脂肪組織に脂肪を蓄えられず、脂肪組織から肝臓に遊離脂肪酸が流れ込むことになる。この結果、肝臓の脂肪沈着やその後の炎症、線維化が促進されることで、NASHが進展すると考えられるという。
また脂肪組織のインスリン抵抗性が肝臓の炎症と線維化を悪化させるもう1つのメカニズムとして、脂肪組織から分泌され、全身の臓器に作用を及ぼす因子「アディポカイン」の関与も考えられるとする。今回、脂肪組織インスリン抵抗性マウスの脂肪組織において、90種類以上のアディポカインの量が変化することが見出されており、脂肪組織のインスリン抵抗性によって、量が変化したアディポカインが肝臓に働くことで、肝臓の炎症や線維化が促進される可能性が想定されるとしている。
今回の研究により、脂肪組織のインスリン抵抗性は、肝臓の炎症と線維化を促進することにより、NASHを悪化させることが解明された。研究チームは、このようなメカニズムが、特に痩せ型のNASHの病態に関与する可能性があるとしており、今回同定された、脂肪組織のインスリン抵抗性によって量が変化するアディポカインの量あるいは作用を調節することができれば、NASHの新しい治療法の開発につながるものと期待されるとした。