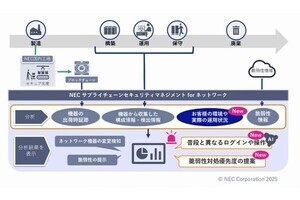
金沢大学(金大)は4月10日、周波数変調原子間力顕微鏡(FM-AFM)を用いて、遺伝子工学的に設計したペプチドがグラファイト表面上で自己組織化することで1分子の厚さの結晶層を形成することを、液中ナノスケール観察により明らかにしたと発表した。
同成果は、金沢大 ナノ生命科学研究所のアイハン・ユルトセベル特任助教、同・リンハオ・スン特任助教、同・福間剛士教授、米・ワシントン大学のメフメト・サリカヤ教授らの国際共同研究チームによるもの。詳細は、米国化学会が刊行するナノサイエンスとナノテクノロジーに関する全般を扱う学術誌「ACS Nano」に掲載された。
小さなタンパク質として知られるペプチドだが、その中には二硫化モリブデン(MoS2)やグラファイトなどの固体表面において、自己組織化するものがある。このような自己組織化ペプチドは、ナノセンサやバイオエレクトロニクスなどのデバイス設計に必要な分子プラットフォームを提供するために重要で、近年関心を集めている。
ペプチドが働いている環境である液中において、分子スケールで構造制御を行うためには、ナノスケールの高い空間分解能で、ペプチドが多次元的に自己組織化する過程やその構造を詳細に理解することが求められている。しかしこれまで、液中でナノスケールの測定を行う方法がなく、その理解は進んでいなかったという。
そこで金大の福間教授が開発したのが、液中での高分解能の測定が可能な周波数変調(FM)を用いたFM-AFM技術だ。今回の研究では、この液中FM-AFM技術を用いて、「指向性進化法」により合成されたグラファイト特異的に吸着するペプチドが、多次元的に自己組織化していく様子について、ナノスケールでのその場観察が試みられた。
-

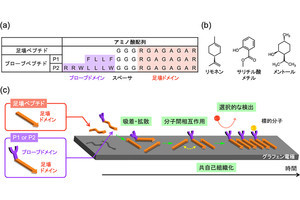
グラファイト吸着性ペプチドと表面現象。アミノ酸配列から、このドデカペプチドは化学的に異なる3つのドメインから構成されていることがわかる。起こり得る表面現象を模式的に示す(出所:金大プレスリリースPDF)
-

水溶液中で取得した自己組織化ペプチドナノ構造体の分子分解能AFM像。(左)第1層の上に第2層が部分的に形成されている。(中央)明るい部分では、第2層が形成され始めている(出所:金大プレスリリースPDF)
この観察の結果、グラファイト上に接しているペプチドの第1層は非常に均質であり、下地のグラファイトの影響により、格子構造を持つ自己組織化結晶が生成されていることが解明された。また第2層は、第1層の結晶欠陥が引き金となって形成されることに加え、第1層とは異なり、ほとんどが不均質な構造を取っていることが確認されたとする。
-

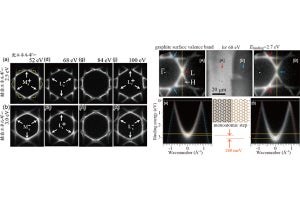
グラファイト表面での自己組織化分子ドメイン(第1層)の形成と成長を示すFM-AFM画像(5μM溶液)。(a)ペプチド結晶ドメインが60°と120°の角度で交差する部分を含む画像。(b)A、B、Cの3つのペプチド結晶ドメインの分子スケール像。(c)結晶と格子定数の対応関係。(d)10分以上にわたる結晶部分の列ごとの成長(出所:金大プレスリリースPDF)
さらに、自己組織化によって形成される結晶構造や核の形成速度は、溶液中に含まれるペプチド濃度に大きく依存することも示された。特に、高濃度のペプチド溶液中で形成される結晶は、ペプチド分子1個が構成単位となり、低濃度ではペプチド分子2個が構成単位となることが、AFM観察と分子力動学シミュレーションの結果から明らかにされたとする。
-
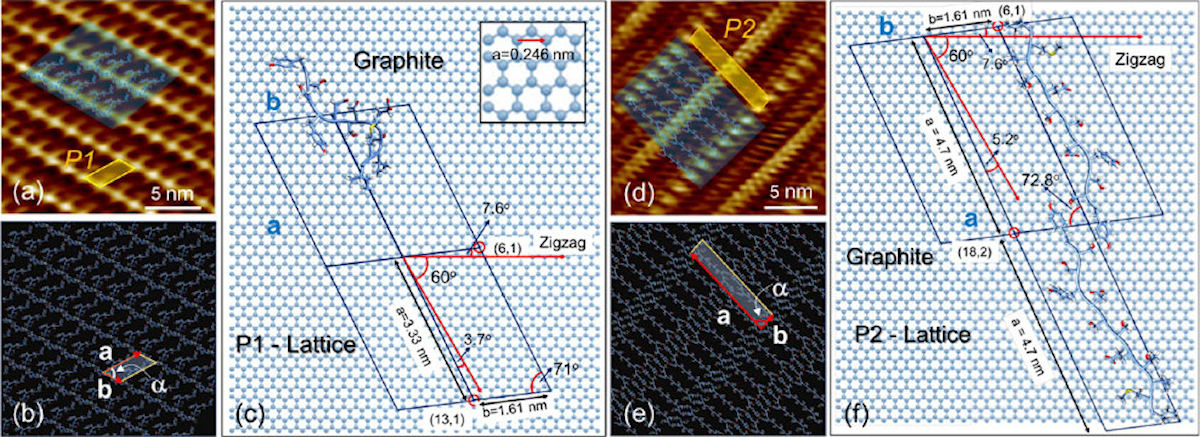
完全に自己組織化された第1層のペプチド結晶の構造。(a-c)は高濃度(100μM以上)、(d-f)は低濃度(10μM以下)ペプチド条件下で形成される結晶構造。(a・d)は高解像度AFM像。(b・e)はペプチド結晶格子のモデル。(c・f)左はペプチド分子1個、右はペプチド分子2個が構成単位。今回の研究のシミュレーションでは、この2種類の構造が使用された(出所:金大プレスリリースPDF)
今回の研究により、グラファイト吸着性ペプチドがグラファイトの原子格子を認識するだけでなく、自身もまた結晶を形成し、ペプチドと固体との間に連続したソフトな界面を確立することが発見された。研究チームによると、ペプチドの自己組織化過程において生じる複雑な表面現象の詳細な理解は、タンパク質やペプチドのアレイ、バイオエレクトロニクス、生体分子デバイスなどのハイブリッドな表面技術に用いるための分子設計の基本指針に貢献することが大きく期待されるという。
なお研究チームは現在、変異体やペプチド周辺の水和構造、ほかの固体基板への影響など、さらなる課題解決に取り組んでいる最中だとする。そして、それによって得られる知見は、生物に着想を得た次世代技術開発のための確固たる科学的基盤を確立する際の基礎になるとしている。