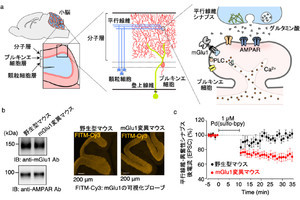
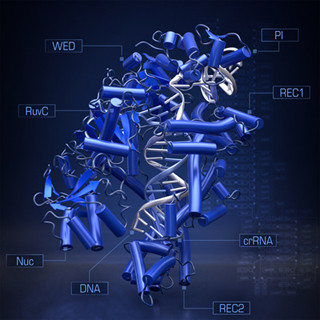
金沢大学(金大)は3月3日、ゲノム編集ツール「CRISPR-Cas9」用の新たなDNA切断酵素として黄色ブドウ球菌から発見された、小型で細胞への導入効率が高い「SaCas9」が、DNAを切断する様子を、高速原子間力顕微鏡(高速AFM)を用いて、ナノスケールかつ数十ミリ秒の時間分解能の動画として撮影することに初めて成功。それを基に、切断ダイナミクスの統一的な理解を得ることを実現したと発表した。
同成果は、金大 ナノ生命科学研究所のLeonardo Puppulin特任助教(研究当時)、金大 ナノ生命科学研究所/新学術創成研究機構の柴田幹大教授、東京大学先端科学技術研究センターの西増弘志教授らの共同研究チームによるもの。詳細は、米国化学会が刊行するナノサイエンスとナノテクノロジーに関する全般を扱う学術誌「ACS Nano」に掲載された。
ゲノム情報を目的に沿って書き換えるゲノム編集ツールのCRISPR-Cas9には、さまざまな細菌に存在するDNA切断酵素のCas9が用いられている。その代表として知られるのが化膿性連鎖球菌由来の「SpCas9」で、最もよく利用されている。しかしSpCas9はタンパク質自体が大きいため、細胞への導入効率が低く、作業効率を高められないという課題があった。
そうした中で発見された黄色ブドウ球菌由来のSaCas9は、タンパク質自体の大きさが小さい上、細胞への導入効率が高く、高効率なゲノム編集に向けて大きく期待されている。しかし、そのDNAへの結合や切断時の構造ダイナミクスなど、まだ解明されていない部分もあった。そこで研究チームは今回、高速AFMを用いて、SaCas9が働く一連の様子を動画として撮影し、ダイナミクスの解明を目指すことにしたという。
高速AFMは金大で開発された顕微鏡技術で、水溶液中にある生きたままの生体分子の動きをナノメートルの空間分解能で、なおかつ数十ミリ秒の時間分解能で撮影することが可能だ。今回の研究ではまず、RNAもDNAも結合していない状態のSaCas9単体について高速AFM観察が行われた。そして、Cas9タンパク質は、タンパク質の中で多くの部分(ドメイン)が正しく重なることで立体構造を形成するが、SaCas9単体は安定な立体構造を採らず、非常に柔軟な構造を採ることが判明したという。