東京大学(東大)は、腱・靱帯が障害を受けた際に出現する、腱・靱帯・骨・軟骨に分化する「プロジェニター細胞」が、損傷した腱・靱帯の修復時に誤って骨や軟骨に分化してしまう仕組みの一端を解明したことを発表した。
同成果は、東大大学院 医学系研究科 外科学専攻感覚・運動機能医学講座 整形外科学の立花直寛大学院生(研究当時)、同・田中栄教授(東大医学部 附属病院整形外科・脊椎外科兼務)、同・齋藤琢准教授(東大医学部 附属病院整形外科・脊椎外科兼務)らの研究チームによるもの。詳細は、米国科学振興協会が刊行する「Science」系のオープンアクセスジャーナル「Science Advances」に掲載された。
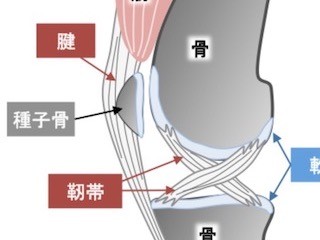
これまでの研究から、腱や靱帯にはプロジェニター細胞が存在し、腱・靱帯が損傷した後の修復を担っていることが分かっていた。しかし、同細胞は腱・靱帯のみならず、軟骨や骨に分化する能力も持っていることから、修復過程で誤って軟骨や骨ができてしまい、腱・靱帯の機能を大きく損なうことがあるという。
プロジェニター細胞が誤った方向に分化してしまうためと推測されてきたが、実際の修復過程でこれらのプロジェニター細胞が軟骨や骨に分化しないように制御し、適切に腱・靱帯に分化するように誘導するメカニズムはまったくわかっていなかった。
また靱帯が骨化する疾患の代表として後縦靱帯骨化症が知られている。後縦靱帯骨化症についてはゲノムワイド関連解析によっていくつかの原因遺伝子が見つかっており、そのうちの1つが「RSPO2」だったという。
RSPO2はWNTシグナルを活性化する分泌タンパクであり、WNTシグナルを介して、靱帯が軟骨や骨に変わるのを抑制していると考えられてきたが、どのような細胞がRSPO2を分泌するのか、RSPO2がどのような細胞に作用するのか、といったことも不明のままだったという。
そこで研究チームは今回、動物モデルを使って調査することにしたという。マウスのアキレス腱を針で穿刺すると、その修復過程において本来できてはならない軟骨や骨が、腱の一部分に生じてしまう。このモデルを用いて1細胞ごとに発現遺伝子を解析するシングルセル解析が行われ、修復過程に関わる細胞がすべて解析された。