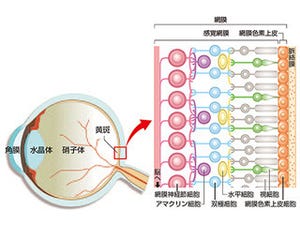
東京大学(東大)ならびに科学技術振興機構(JST)は4月15日、眼の水晶体を透明にする仕組みとして、新たな細胞内分解システムを発見したと発表した。
同成果は、東大大学院 医学系研究科 分子細胞生物学専攻 分子生物学分野の森下英晃助教(研究当時、現・同大学大学院 研究科客員研究員/順天堂大学 大学院医学研究科 講師)、同・江口智也 特任助教、同・水島昇 教授らの研究チームによるもの。詳細は、英科学誌「Nature」に掲載された。
人間の体は大量の細胞で構成されており、その数は最近の研究では約37兆とされている。そして、それぞれ用途や能力の異なる数多くの種類の細胞があるが、構造としては、DNAが収まっている核があり、その周囲にエネルギーを生み出すためのミトコンドリアや小胞体などといった「細胞小器官」が備わっている。人の生命が体内のさまざまな臓器によって支えられているように、細胞もそうした細胞小器官が機能することで、日々活動することができている。
しかし人体において、成熟する過程で細胞小器官が消失してしまう特殊な細胞がある。それが眼の水晶体だ。水晶体は光を網膜に集める機能を担う透明な組織であり、水晶体で起こる大規模な細胞小器官の分解は、水晶体の機能獲得に重要な役割を果たしていると考察されてきたが、その詳細な仕組みや意義はほとんど明らかにされてこなかったという。
例えば、水晶体は上皮細胞とそれから分化した線維細胞によって構成されているが、細胞小器官の分解は、線維細胞への分化の最終段階で起こることが分かっており、これまでの研究から、核DNAを分解する酵素は同定されていたものの、そのほかのミトコンドリアや小胞体、リソソームといった細胞小器官の分解の仕組みはよくわかっていなかったという。
通常の細胞では、「オートファジー」と呼ばれる仕組みが細胞小器官の分解を担うが、研究チームの先行研究から、水晶体の細胞小器官の分解にはオートファジーが必要ないことが見出されており、水晶体にはオートファジーとは異なる、まだ発見されていない細胞小器官分解システムが存在することが予想されていたとする。
そこで研究チームは、水晶体の細胞小器官が分解される仕組みを解析するためのモデルとしてゼブラフィッシュを活用して今回、研究を行ったという。
まず、ゼブラフィッシュが生きたままの状態で水晶体の細胞小器官観察を実施。その結果、実際に細胞小器官が分解され、それらの内容物がサイトゾル(細胞内の核以外の部分で、細胞小器官や細胞骨格などの大型構造を除いた可溶性の部分のこと)へと拡散していく様子がとらえられたとする。また、ゼブラフィッシュの水晶体で高発現している遺伝子など約60種類の候補遺伝子群を対象として、「CRISPR/Cas9」システムを用いた遺伝子破壊スクリーニングが実施したところ、細胞小器官の分解には脂質分解酵素の一種である「ホスホリパーゼAファミリー」に属し、生体膜を構成するグリセロリン脂質などを分解する脂質代謝酵素として知られる「Plaat1」が必要であることが明らかとなった。
-

ゼブラフィッシュ水晶体における大規模な細胞小器官分解には脂質分解酵素Plaat1が必須であることが判明した。(A)ゼブラフィッシュ(受精後62 時間前後)の水晶体のモデル図。(B)小胞体(緑色)とミトコンドリア(赤色)の内部に蛍光タンパク質を発現させたゼブラフィッシュの水晶体のライブイメージング解析。正常なゼブラフィッシュでは、受精後72時間で小胞体やミトコンドリアの内容物がサイトゾルへ拡散する。plaat1欠損ゼブラフィッシュでは、受精後72時間でも水晶体中心部の線維細胞に、粒状の輝点(小胞体やミトコンドリア)が残る (出所:プレスリリースPDF)
-

ゼブラフィッシュ水晶体においてPlaat1がミトコンドリアを分解する過程のライブイメージング。(A)ゼブラフィッシュ水晶体において、Plaat1がミトコンドリアに局在すると、数十分でミトコンドリアが分解される。生きたゼブラフィッシュの水晶体のライブイメージング画像。(B)Plaat1は、その疎水性領域を介して細胞小器官の膜へ局在化すると考えられるという (出所:プレスリリースPDF)
Plaat1は普段はサイトゾルに存在しており、細胞小器官の分解直前にそれらの膜へ移行するが、膜への移行には、Plaat1の疎水性領域が必要であり、ミトコンドリアやリソソームの膜が部分的に損傷を受けるとPlaat1が膜に移行することも確認されたほか、その膜移行には、水晶体の発生に必要な転写調節因子「Hsf4」が必要であることも判明したという。
-

PLAATは分解直前に細胞小器官の膜へ移行する。PLAATなどのホスホリパーゼAファミリー酵素は、通常サイトゾルに存在する。Hsf4発現後に起こる細胞小器官膜上の損傷を認識して、サイトゾルから膜へと移行し、細胞小器官の膜の破壊や分解を引き起こす (出所:プレスリリースPDF)
ホスホリパーゼAファミリー酵素は、哺乳動物を含めた脊椎動物に広く備わっており、マウスの場合では、「PLAAT3」が水晶体細胞の細胞小器官分解に必要であることが確かめられたとのことで、Plaat1欠損ゼブラフィッシュおよびPLAAT3欠損マウスの水晶体では、白内障(水晶体の混濁)や光の屈折異常が見られたことから、PLAATファミリー酵素による大規模な細胞小器官分解は、水晶体の透明化に必要であると考えられるとしている。
-

脂質代謝酵素PLAAT3の遺伝子である「Plaat3」を欠損したマウスの水晶体は、白内障と屈折異常を示す。(A)9カ月齢のマウスの水晶体の外観。Plaat3欠損マウスの水晶体は、白内障の症状を示しているのが見て取れる。(B)9カ月齢のマウスの水晶体のグリッド上での明視野像。Plaat3欠損マウスの水晶体では、グリッドパターンのゆがみ、すなわち屈折異常が生じているのがわかる (出所:プレスリリースPDF)
なお、研究チームでは、ホスホリパーゼAファミリー酵素は、水晶体以外のさまざまな組織でも発現しており、細胞内環境の改変や恒常性維持などに寄与している可能性が考えられるとしており、今後、この新しい細胞小器官分解システムの詳細な分子機構や機能、そしてオートファジーやユビキチン・プロテアソームシステムなどのほかの細胞内分解システムとの違いや関係性が解明されていくことで、細胞内分解システムの包括的理解につながることが期待されるとしている。