岡山大学と豊橋技術科学大学は9月7日、海馬興奮性ニューロンの後シナプスに流入するカルシウムイオンの多寡に依存した「AMPA型グルタミン酸受容体」の「エキソサイトーシス」と「エンドサイトーシス」の競合に注目することで、海馬興奮性シナプスの「長期増強」と「長期抑制」を統一的に理解できることを大規模なコンピューターシミュレーションにより実証したと共同で発表した。
同成果は、岡山大学異分野基礎科学研究所の墨智成 准教授、豊橋技術科学大学情報・知能工学系の原田耕治 助教らの共同研究チームによるもの。詳細は、英科学雑誌「Scientific Reports」に掲載された。
シナプスとは、ニューロン(神経細胞)間の接合部位のことであり、情報伝達を担う。そのシナプスのうち、情報を送る側は前シナプス、情報を受け取る側は後シナプスと呼ばれる。前後のシナプス間には「シナプス間隙」と呼ばれるすき間があり、その間の情報伝達は化学物質であるグルタミン酸によって行われる。前シナプスから放出されたグルタミン酸は、シナプス後膜(後シナプスのシナプス間隙に面した表面の形質膜部分のこと)に発現するイオンチャネルのグルタミン酸受容体に結合し、興奮情報を前シナプスから後シナプスへと伝える。ひとつのニューロンにおいては興奮情報は電気信号として伝わるが、ニューロン間はこのように、化学的に伝えられる。脳の情報伝達は電気と化学物質で成り立っている。
そしてグルタミン酸受容体にはAMPA型やNMDA型など、複数のタイプが存在する。AMPA型もNMDA型も、前シナプスから放出されたグルタミン酸と結合すると、カルシウムイオンなどの陽イオンを後シナプス細胞内へ透過させるゲート的な役割を担っている点ではほぼ同じだが、若干性質に差があり、分類されている。
海馬興奮性ニューロンのシナプスにおいては、カルシウムイオンの多寡に応じてAMPA型が増減することが確認されている。そして、それに連動する形で、NMDA型グルタミン酸受容体に依存した記憶の長期増強と長期抑制が発現する仕組みも判明している。長期増強とは、前後のシナプス間の結合強度が基底状態に比べて長期間(数時間)強め合う現象のことで、このときにシナプス後膜ではAMPA型が増加する。一方、長期抑制は逆に基底状態に比べて長期間弱め合う現象のことで、このときにAMPA型が減少することがわかっている。
長期増強と長期抑制は、学習や記憶に関わる神経回路形成に不可欠な分子基盤と考えられているが、まだまだ未解明な部分も多い。そのひとつがAMPA型の増減の機序だ。また後シナプスのAMPA型の輸送経路に関しても、主要な経路を巡って「AMPA型の長距離側方拡散」と「ミオシンVb分子モーターによる能動的輸送」の2説で論争が続けられている。なおミオシンとは、アクチンタンパク質上を移動するモータータンパク質のことで、動物の筋肉はアクチンとミオシンから成り立っている。
そこで共同研究チームは今回、長期増強と長期抑制を統一的に説明するため、AMPA型の供給経路として、「ミオシンVb分子モーターによる能動的輸送」を重視した後シナプスのモデルを提案した。
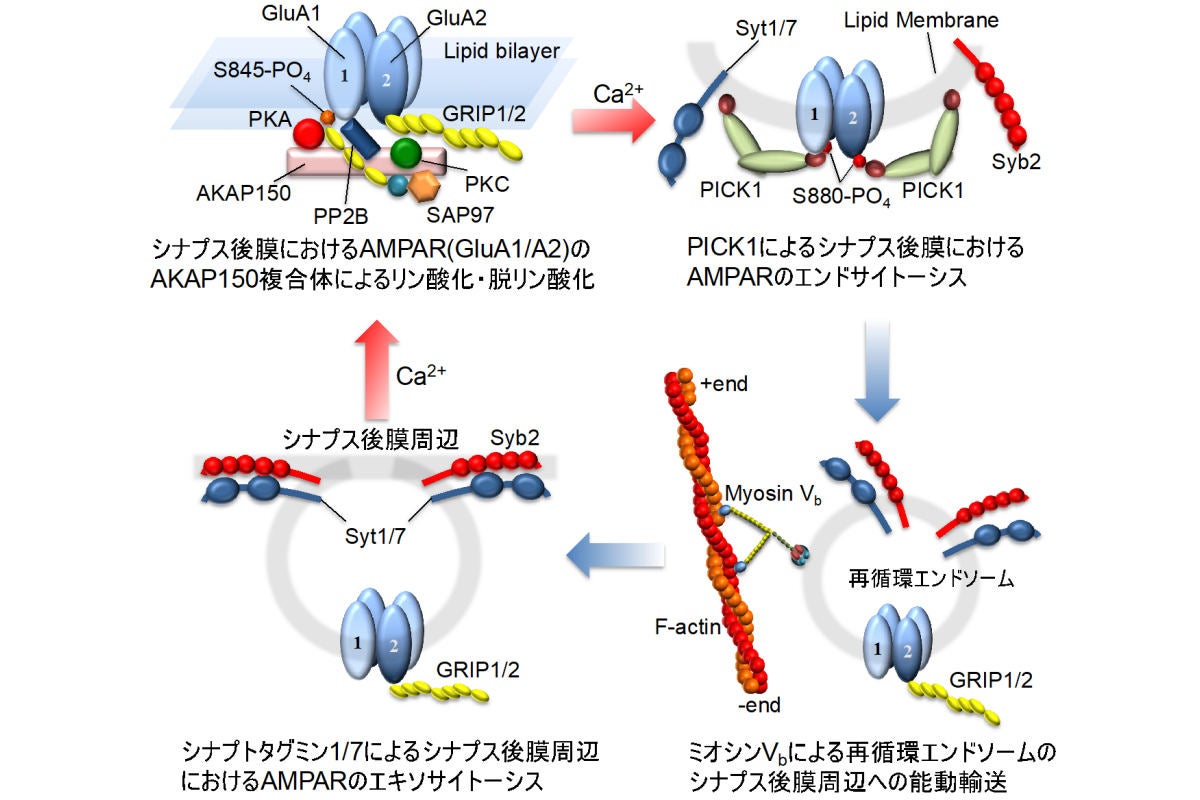
AMPA型は通常、「GluA1-GluA4サブユニット」から成る4量体として形成されている。それが海馬興奮性シナプスでは、「GluA1」と「GluA2」が各ふたつずつで構成された「GluA1/A2ヘテロ4量体」が主要なタイプであることが知られており、今回の研究ではその点が考慮されたという。そして、以下の4つのプロセスとしてモデル化が行われた。
- シナプス硬膜におけるAMPA型を構成するサブユニットGluA1とGluA2の「AKAP150シグナル伝達複合体」によるリン酸化/脱リン酸化
- カルシウム結合タンパク質「PICK1」による、シナプス硬膜におけるAMPA型の細胞質へのエンドサイトーシス(エンドサイトーシス:細胞が細胞外の物質を取り込む過程のひとつの段階のこと)
- エンドサイトーシスで細胞質内に取り込まれたAMPA型含有再循環エンドソームの、分子モーター「ミオシンVb」によるシナプス後膜周辺方向への能動的輸送(エンドソーム:細胞内に存在する小胞のことで、細胞外の物質の取り込みなどに関わる)
- カルシウム結合タンパク質「シナプトタグミン1/7」による、AMPA型含有再循環エンドソームのカルシウム依存エキソサイトーシスによるシナプス後膜周辺への取り込み(エキソサイトーシス:開口分泌ともいい、細胞が細胞外へ細胞内で合成された物質を分泌する方式のひとつ)
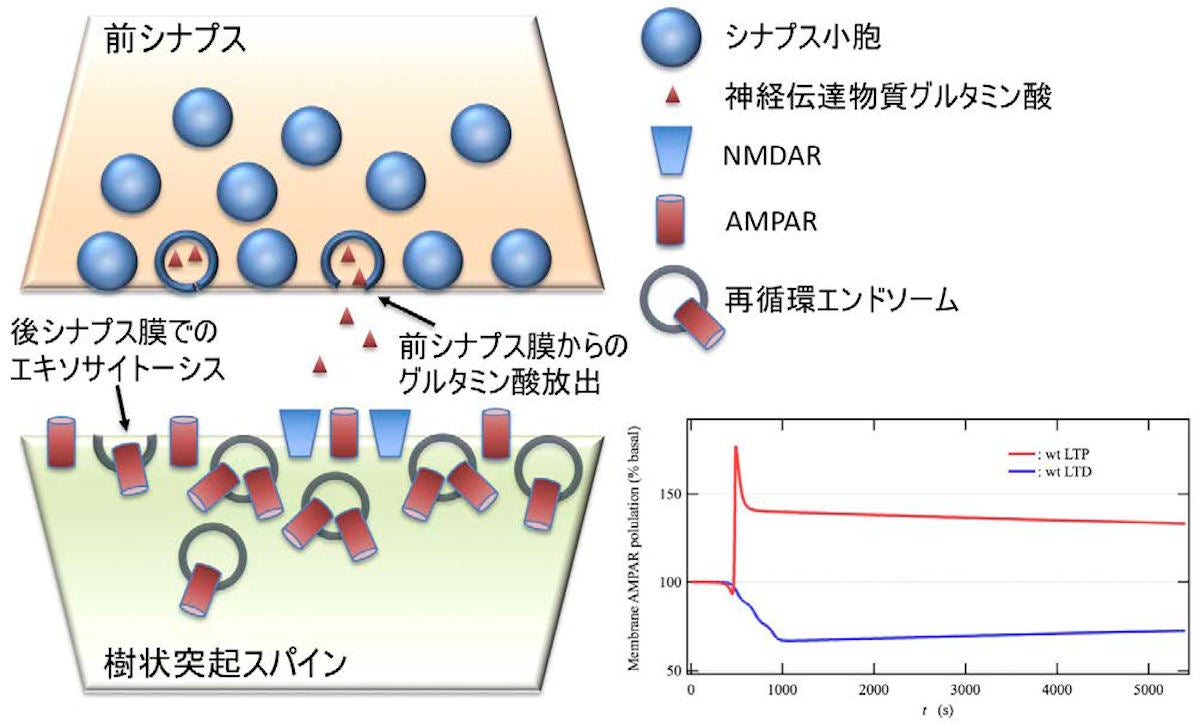
共同研究チームはこれらに基づく後シナプスモデルを用いたシミュレーションを実行し、実験で観測されている長期増強と長期抑制誘導に対応するAMPA型の数の時間変化の再現が行われた。そして、「ミオシンVb分子モーター輸送の阻害による長期増強誘導の減少」など、これまでに報告されている複数の観測結果を定性的に再現できることが示され、今回のモデルの妥当性を実証したとしている。今回のシミュレーションから導かれた結論は、以下の5点だという。
- 長期増強と長期抑制の発現は、カルシウム結合タンパク質PICK1によるエキソサイトーシスおよびカルシウム結合タンパク質シナプトタグミン1および7によるエンドサイトーシスの相対的強弱の結果として、シナプス後膜上にAMPA型の数が増減することに起因する
- PICK1およびシナプトタグミン1のカルシウム依存活性化は、これらのカルシウム結合定数の大きな違いに帰着する
- ミオシンVb分子モーターはカルシウム濃度に依存しない定常的なATP(ATP:アデノシン三リン酸、生物が活動するためのエネルギーの基本通過といわれる物質)駆動輸送により、AMPA型含有再循環エンドソームをシナプス後膜周辺方向へ運搬している
- その結果として、次回のシナプトタグミン1依存エキソサイトーシスに即時対応できるように、再循環エンドソームは細胞膜上で待機しており、迅速な長期増強の誘導を可能にしている
- 実験観測および今回の研究の結果により、エキソサイトーシスによってシナプス後膜周辺へ取り込まれたAMPA型は、側方拡散によりシナプス膜へ即座に再配置する
近年のAIの発展に大きく関わる、脳の高次機能を模したニューラルネットワークでは、シナプス結合係数の変化が学習に対応しており、最も基本的な学習則として「ヘブ則」が知られている。ヘブ則とは、シナプス前ニューロンの繰り返し発火によって、シナプス後ニューロンの発火が起こると、そのシナプスの伝達効率が増強され、逆に発火が長時間起こらないと、そのシナプスの伝達効率は減退するという法則だ。
ヘブ則もしくはその拡張版や変形版が、現在でも学習則として用いられており、NMDA型グルタミン酸受容体に依存した長期増強と密接に関係することが知られている。今回の研究成果は、ヘブ則あるいはシナプス結合の変化に対する分子基盤を与えており、分子レベルから脳の高次機能を理解する手がかりになることが期待されると、共同研究チームは述べている。