早稲田大学は、体内時計の食事による同調において新規なメカニズムを発見したと発表した。タンパク質が豊富な食事をマウスに与えることにより、食事性同調を引き起こすという。この結果は、肥満防止や糖尿病治療への貢献に期待できるということだ。
同研究は、早稲田大学理工学術院の柴田重信 教授と一貫制博士課程5年生の池田祐子氏らの研究グループによるもので、同研究成果は、1月21日オープンアクセス誌「EBioMedicine」オンライン版に掲載された。
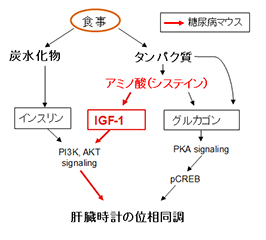
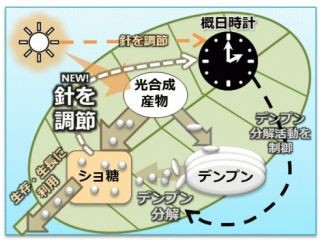
体内時計は、視交叉上核という主時計と、末梢臓器にある末梢時計から成り立っている。体内時計は24時間よりずれており、視交叉上核の主時計は主に外界の光刺激で24時間周期に同調し、末梢時計は食事刺激で同調することが知られている。食事による同調のメカニズムは、血糖上昇にともなうインスリンの分泌とその後の細胞内シグナルによることが知られているが、1型糖尿病モデルマウスでは、インスリン分泌は起こらないにも関わらず、食事性の同調は十分に観察される。つまり、インスリンを介する同調以外のシグナル系が存在する可能性が強く示唆されていた。
同研究グループは、正常なマウスおよび1型糖尿病モデルマウスを用いて高タンパク質食を与える実験を行い、タンパク質が豊富な食事は新規なIGF-1やグルカゴンのシグナル系を使い、食事性同調を引き起こすことを見出した。肥満防止や糖尿病治療には低炭水化物食が好まれているが、この場合でも、インスリンに代わってIGF-1のシグナルで食事性同調を作りだすことが出来る可能性を提示できたという。さらに、安価なアミノ酸であるシステインでも十分に食事性同調を引き起こせたので、将来的に低炭水化物食に添加するなど、糖尿病の新規な食事療法の選択肢になる可能性が示唆された。
実際、朝食による同調は損なわずに食後高血糖を避けるために高炭水化物食ではなく高タンパク質食を勧める同研究成果は、臨床における2型糖尿病での朝食の食事療法と類似している。また、American Diabetes Association(ADA)やNational Health Service UK(NHS UK)は、現在50g~55gのタンパク質を健常者・糖尿病者に推奨しており、これは総エネルギーの15%~20%をタンパク質から取ることになり、同研究の成果とも合致する。システインは医薬品としてばかりでなく、安価な食材としても利用されているので、ヒトを対象とした臨床試験も大いに期待できるという。
同研究はマウスのデータであり、この成果をもとにヒトの介入試験等を早々に進め、マウスの知見を実証する必要がある。また、1型のみならず2型糖尿病モデルマウスを用いて、今回の研究結果を確認する必要がある。今回はシステインのみ候補としたが、アミノ酸も組み合わせによっては、より強力な作用が見いだせる可能性があり、そのような研究も進める必要があるということだ。