京都大学iPS細胞研究所(京大CiRA)は5月25日、筋萎縮性側索硬化症(ALS)患者由来iPS細胞を用いて治療薬探索のための薬剤スクリーニングを行い、ALSの治療標的となる分子経路とALS運動ニューロンの細胞死を抑える既存薬を同定したと発表した。
同成果は、京都大学CiRA増殖分化機構研究部門 今村恵子特定拠点助教および井上治久教授らの研究グループによるもので、5月25日日付の米国科学誌「Science Translational Medicine」オンライン版に掲載された。
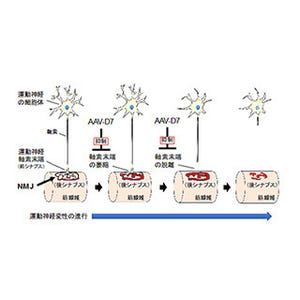
ALSは、運動ニューロンが進行性に変性して筋萎縮と筋力低下を来す疾患。これまでALSのメカニズムの詳細は明らかになっておらず、十分な治療法はないといえる。ALSはほとんどの場合が孤発性だが、家族性では、遺伝要因としてSOD1遺伝子やTDP-43遺伝子の変異、C9orf72遺伝子内のくり返し配列の伸長などが知られている。
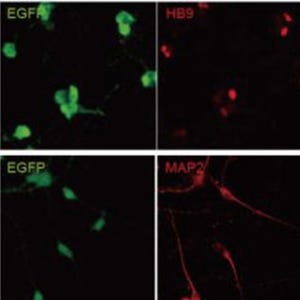
今回、同研究グループは、SOD1遺伝子に変異を有する家族性ALS患者から作製したiPS細胞、遺伝子変異を修復したiPS細胞と健常者から作製したiPS細胞(対照群)に、Lhx3、Ngn2、Isl1という3つの転写因子を加えて運動ニューロンへと分化させる実験を行った。
この結果、患者由来運動ニューロンでは異常に折りたたまれたタンパク質が蓄積し、細胞死を起こしやすいことがわかった。そこで、SOD1変異を有する家族性ALS患者由来運動ニューロンを用いて、細胞死を標的としたスクリーニング系を構築。既存薬を含む1416個の化合物についてスクリーニングを行ったところ、27個の薬が細胞死を強く抑えることがわかった。
また、このうち約半数がSrc/c-Ablというタンパク質の分子経路に関連していることがわかった。さらに、細胞死を強く抑える化合物のなかで、慢性骨髄性白血病の治療薬として用いられている既存薬「ボスチニブ」は、細胞の自食作用であるオートファジーを促進し、ALSの病態のひとつである異常に折りたたまれたタンパク質を減らすことが明らかになった。
同研究グループは、ボスチニブをSOD1変異を有するALSマウスに投与し、その有効性を確認している。また、TDP-43遺伝子変異あるいはC9orf72リピート伸長を有する家族性ALS患者由来iPS細胞から作製した運動ニューロンや、孤発性ALS患者由来iPS細胞から作製した運動ニューロンの一部でもボスチニブが細胞死を抑制することも確認している。
今回の成果は、今後のALSの治療薬開発研究に貢献するものと期待される。今後、生体内での薬の有効濃度や髄液への移行性、安全性などを詳細に調べていく必要がある。