産業技術総合研究所(産総研)は3月16日、アルツハイマー病の原因因子のひとつ「アミロイドβタンパク質(Aβ)」の動態を、生きた神経細胞内や生体内で可視化する技術の開発に成功したと発表した。
同成果は、産総研 バイオメディカル研究部門 脳遺伝子研究グループ 落石知世 主任研究員、北海道大学大学院 先端生命科学研究院 北村朗 助教、順天堂大学 医学部 脳神経内科 志村秀樹 准教授らの研究グループによるもので、3月16日付けの英国科学誌「Scientific Reports」電子版に掲載された。
アルツハイマー病発症のメカニズムとして近年、少数のAβ分子が重合したAβオリゴマーが細胞に対する強い毒性を有し、これが細胞内に蓄積されることが病気の発症に強く関与するという説が有力になりつつある。しかし従来の方法では、細胞や脳組織の標本を用いた解析しかできなかったため、生きた細胞内でAβのオリゴマー化の状態を直接可視化して毒性との因果関係を詳細に解析する方法の開発が求められていた。
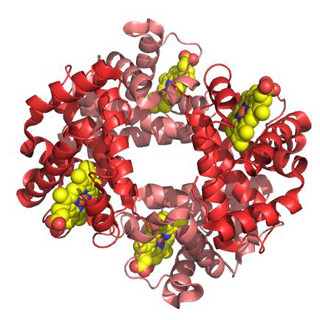
これまでにAβと蛍光タンパク質GFPを繋ぐリンカーとして12個以下のアミノ酸から構成されたものが報告されていたが、これらはAβが重合するとGFPの蛍光が消失するため、Aβオリゴマーの観察はできない。今回、同研究グループは、AβとGFPを繋ぐリンカーとして14個のアミノ酸を用いて、Aβ分子の重合体が形成されても蛍光を観察できるAβ-GFP融合タンパク質(Aβ-GFP)を開発した。
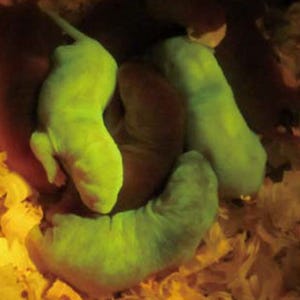
このAβ-GFPを核磁気共鳴装置や電子顕微鏡、免疫組織化学法、蛍光相関分光法で解析したところ、GFPを融合させたことでAβの重合が一定以上進まず、生体内でも生体外でも2量体から4量体を中心としたオリゴマーの状態で存在することがわかった。これらの特徴を活かすことで、生きた細胞内でAβのダイナミックな動きや、初代培養神経細胞内での蓄積状態などの解析が可能となる。また、重合が進んで繊維状となったAβよりも、オリゴマーのほうがより強い毒性を有することから、Aβオリゴマーの重合の度合いと細胞への毒性との関係などの解析を行うことができる。
また、AβとGFPを繋ぐリンカーが短いと、重合の影響を受けてGFPの蛍光は観察されなくなる。そこで同研究グループは、今回発見した現象を利用して重合の状態が検出できるシステムを考案。GFPの蛍光強度の変化を測定することで、Aβの重合を抑える創薬候補物質のスクリーニングに利用できることを実証した。
同研究グループは今後、培養神経細胞を用いて、Aβ-GFPの蛍光強度を利用したアルツハイマー病の治療薬や予防薬の候補となる物質をより簡便にスクリーニングできる方法の開発に着手する。また、Aβ-GFPを発現させたトランスジェニックマウスを用いて、アルツハイマー病発症のごく初期に起こる神経細胞内部での微細な変化にAβオリゴマーが与える影響についてより詳細な解析を行い、アルツハイマー病発症のメカニズムの解明や予防に関する研究を進めていくとしている。