東京大学(東大)と京都大学(京大)は、「副腎皮質刺激ホルモン(ACTH)非依存性クッシング症候群」の半数以上において「PRKACA遺伝子」の変異が生じていることを明らかとし、さらにこの変異によって脳下垂体からの制御に従わず副腎腫瘍が持続的になおかつ過剰にステロイドホルモン「コルチゾール」を産生するメカニズムを解明したと共同発表した。
成果は、東大大学院医学系研究科 泌尿器外科学の本間之夫 教授、同・大学院 理学系研究科 生物科学専攻の濡木理 教授、同・大学医科学研究所附属ヒトゲノム解析センターの宮野悟 教授、同・病理学専攻の深山正久 教授、京大大学院 医学研究科 腫瘍生物学講座の小川誠司 教授、同・佐藤悠佑 特定助教らの共同研究チームによるもの。
研究は文部科学省科学研究費補助金新学術領域研究「システム的統合理解に基づくがんの先端的診断、治療、予防法の開発」ならびに内閣府/日本学術振興会最先端研究開発支援プログラム(FIRSTプログラム)の一環として行われたもので、詳細な内容は5月23日付けで米科学誌「Science」に掲載された。
コルチゾールは生体に必須なステロイドホルモンだが、クッシング症候群では、副腎から同ホルモンが持続的に、そして過剰に産生されることにより、多彩な症状を引き起こしてしまう疾患で、20代~40代の女性に多く発生する。コルチゾールは起床時に多く分泌され、就寝時には分泌量が低下するのが正常な状態だが、クッシング症候群では常に多量のコルチゾールが分泌されてしまうことから、糖尿病や高血圧、肥満、骨粗鬆症、うつなどのさまざまな症状が出現してしまう。
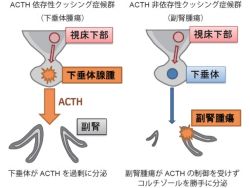
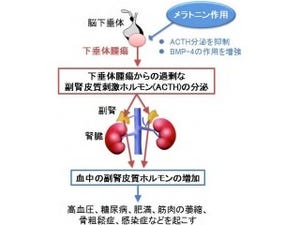
コルチゾールは、脳下垂体から分泌されるACTHによって副腎が刺激を受けた時に産生される仕組みだ。そして、クッシング症候群での持続的なコルチゾール分泌には大きく分けて次のような2つのパターンがある。1つ目は脳下垂体の腫瘍が原因となり、ACTHが多量に分泌され、それに反応して副腎がコルチゾールを産生してしまうタイプだ。これはACTH依存性クッシング症候群と呼ばれる(画像1)。
そしてもう1つは、副腎腫瘍が原因となってACTHによる刺激がなくても勝手にコルチゾールを産生してしまうタイプで、こちらがACTH非依存性クッシング症候群だ(画像1)。ACTH非依存性クッシング症候群において、どのようなメカニズムでコルチゾールが持続的に産生されているのかは、これまで明らかではなかった。
研究チームはまず、ACTH非依存性クッシング症候群の原因となる遺伝子変異を明らかにするため、まず8例のDNAが患者の副腎腫瘍から採取され、エクソン(タンパク質をコードする領域)の全塩基配列の解読を実施。そしてこれらの症例において、副腎腫瘍で生じている遺伝子変異の検索が行われた。その結果、8例中4例にPRKACA遺伝子の変異が検出されたのである。
PRKACA遺伝子は「プロテインキナーゼA(PKA)」の触媒サブユニット(PRKACA)をコードする遺伝子だ。PKAは2つのPRKACAと2つの調節サブユニットからなり、PRKACAが活性化することで細胞の代謝の調節などに関与する。PKAは、「セカンドメッセンジャー」と呼ばれる「サイクリックAMP(cAMP)」によって活性化される代表的な分子で、標的となるタンパク質をリン酸化することで細胞の代謝の調節などに関与する酵素だ。またcAMPは、「アデニル酸シクラーゼ」によって「アデノシン三リン酸(ATP)」から合成され、ホルモンなど、細胞に対する外部からの刺激によって合成が促され、それを細胞内に伝達することから、「セカンドメッセンジャー」と呼ばれている。
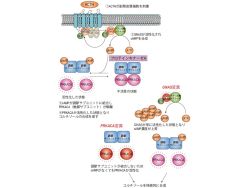
通常PRKACAは調節サブユニットが結合することで不活性の状態となっているが、ACTHの刺激により細胞内のcAMPの濃度が上昇すると、触媒サブユニットが調節サブユニットから離れることによって活性化した状態となり、コルチゾールの産生を促すといわれている(画像2)。
また、cAMPの産生に関わる遺伝子である、「GNAS遺伝子」の変異が8例中1例に認められた。GNAS遺伝子は、ほかの疾患ではしばしば変異することが知られており、変異によって細胞内のcAMPの濃度が持続的に上昇するといわれている(画像2)。
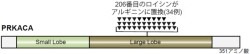
そこで研究チームはこれら2つの遺伝子に注目し、さらに57例を追加して(合計65例)変異の有無の調査を行った。すると、65例中34例(52%)にPRKACA遺伝子の変異が、11例(17%)にGNAS遺伝子の変異が認められたのである。両者の変異が共に生じている症例はなく、合計で45例(69%)の症例に、cAMPとPKAを介する経路の異常が生じていることが示唆されたという。また、PRKACA遺伝子の変異は特定のアミノ酸(206番目のロイシン)に対応する塩基にのみ生じており(画像3)、研究チームではそのことを「興味深いこと」としている。
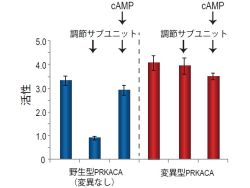
そこで研究チームは、PRKACA遺伝子の変異により、どのようにしてコルチゾールが持続的に産生されるのか、そのメカニズムを解明するために、野生型PRKACAタンパク(変異なし)および変異型PRKACAタンパクを用いた実験を実施した。すると、野生型PRKACAは、調節サブユニットを加えると両者が結合してPRKACAの活性が下がり、これにさらにcAMPを加えると調節サブユニットが離れ、再びPRKACAが活性化することが判明(画像4)。
それに対して、変異型PRKACAの場合は、調節サブユニットを加えても結合せず、cAMPの有無にかかわらずPRKACAが活性化した状態を維持していることが確認された(画像4)。このことから、ACTH非依存性クッシング症候群の内半数以上の症例では、PRKACA遺伝子が変異することにより、調節サブユニットによるPRKACAの抑制が不可能となるため、ACTHの刺激によるcAMP濃度の上昇がなくても持続的にコルチゾールの産生が促されるものと、研究チームは結論付けるに至ったのである(画像2)。
研究チームは今回の成果を踏まえ、今後の研究によりACTH非依存性クッシング症候群の新たな診断方法や治療法の開発が進んでいくことが期待されるとしている。