国立精神・神経医療研究センター(NCNP)は2月22日、日本において患者数が急速に増加しつつある「多発性硬化症(MS)」の新しい治療法の開発につながる発症メカニズムの解明と病態改善の手がかりを発見したと発表した。
成果は、NCNP 神経研究所 免疫研究部の山村隆 部長、同・大木伸司 室長、同・ベン・レイバニー研究員らの研究グループによるもの。研究の詳細な内容は、日本時間2月22日付けで米オンライン科学誌「PLoS ONE」に掲載された。
近年、国内における多発性硬化症は増加しており、患者数はこの30年間で20倍以上(約1万3000人)に増加したといわれている。
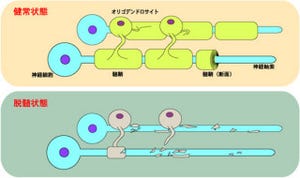
多発性硬化症は神経繊維を取り囲む「髄鞘」が破壊されることによる伝導障害を主徴とする中枢神経系の脱髄疾患の1種で、近年、日本における患者数は増加傾向にあり、この30年間で20倍以上(約1万3000人)に増加したと言われている。
発症の引き金として、髄鞘に分布するタンパク質に対して自身の免疫系が攻撃を行う、自己免疫応答が重要な役割を担うと考えられており、その治療法としては、免疫を抑制する「副腎皮質ステロイドホルモン」や液性タンパクである「インターフェロンβ」などがあるが、必ずしもすべての患者に効果があるというわけではなく、より効果的な治療法の開発が求められている。
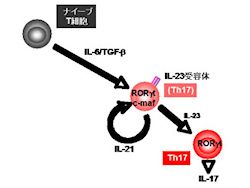
多発性硬化症などの自己免疫疾患は、自らを攻撃してしまう「病原性Tリンパ球」がその発症のメカニズムに深く関与していると考えられ、中でも炎症性サイトカインである「インターロイキン17(IL-17)」を産生する「Th17細胞」が注目されるようになってきており、これらの疾患を克服するために病原性リンパ球の機能制御が必須と考えられるようになってきた。しかし、現在、治験段階に進んでいる各種の抗サイトカイン療法については、これまでのところ必ずしも十分な成果を得るに至っておらず、病原性リンパ球そのものを標的とした治療法の確立が望まれるようになってきた。
研究グループはこれまでの研究から、患者由来の「末梢血T細胞」から核内受容体であるタンパク質「NR4A2」を同定し、多発性硬化症の炎症を引き起こすサイトカインを分泌するIL-17の活性化にNR4A2が関与していることを明らかにしてきており、今回の研究では、そのNR4A2に着目し、髄鞘由来タンパク質あるいはその部分ペプチドを免疫することで誘導可能な、多発性硬化症の動物モデルである「実験的自己免疫性脳脊髄炎(EAE)マウス」を用いて、病原性T細胞の機能解析が行われた。
解析の結果、NR4A2は高い病原性を有し、IL-17を産生するTh17細胞だけに発現することが判明したほか、NR4A2に特異的に働きかけるsiRNA(NR4A2特異的2本鎖RNA)でT細胞を処理したところ、Th17細胞の分化に深く関わる遺伝子群の発現が抑制され、同時に炎症を引き起こすサイトカインを分泌するIL-17の発現も消失することが確認されたとする。
また、「インターロイキン-21(IL-21)」を外から添加すると、「インターロイキン-23(IL-23)受容体」とIL-17の産生が濃度依存的に回復することを確認。このことから、IL-21がNR4A2によるT細胞のIL-17産生制御における標的分子であることが確認されたという。
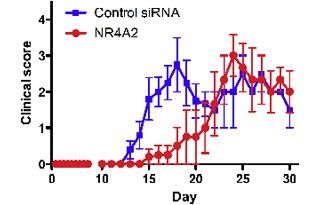
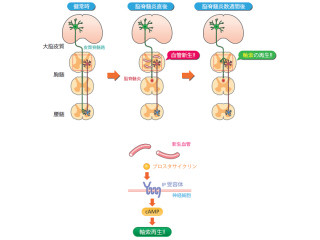
さらに、「NR4A2特異的siRNA」をマウスに投与してEAEの病態が改善できるかを確認したところ、EAE誘導時にマウスに1回静脈投与したところ、siRNA投与群ではEAEの病態の有意な改善が見られ、併せて中枢神経系あるいは末梢血に分布したT細胞で、NR4A2の発現とIL-17産生が有意に抑制されることが確認されたという。
この効果は、時間と共に減弱することも確認されたが、これはsiRNAが体内で徐々に分解されたことによるものであることが考えられる研究グループでは説明する。
今回の成果は、NR4A2特異的siRNAなどの合成核酸が、多発性硬化症などのT細胞依存性自己免疫疾患の病態改善に有効である可能性を示すものであるほか、NR4A2によるTh17細胞機能制御メカニズムが解明されたことから、研究グループでは、例えばIL-21遺伝子などの発現抑制を指標とした、NR4A2を標的とする小分子化合物のスクリーニングによる新規治療薬の同定への道が開かれ、多発性硬化症に対する新たな治療法の確立につながる可能性がでてきたとコメントしている。