科学技術振興機構(JST)と愛媛大学は4月2日、千葉大学、かずさDNA研究所、理化学研究所(理研)の協力を得て、老化に伴う免疫機能異常のメカニズムの一端を明らかにしたと共同で発表した。
成果は、愛媛大大学院 医学系研究科の山下政克教授は、同・医学部附属病院 先端医療創生センターの桑原誠助教、千葉大大学院 医学研究院の中山俊憲 教授、かずさDNA研究所 ヒトゲノム研究部の小原収 部長、理研 統合医科学研究センター 分化制御研究チームの黒崎知博グループディレクターらの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は現地時間4月2日付けで英科学誌「Nature Communications」に掲載された。
人体の免疫機能は大別して「自然免疫」と「獲得免疫」がある。後者は、遭遇した抗原(病原体)に対する仕組みとして、T細胞やB細胞などのリンパ球により担われており、特異的かつ最適な反応を誘導し記憶するシステムだ。しかし老化により獲得免疫は低下・劣化する「免疫老化」が起きてしまう。それにより過剰な炎症反応も引き起こされ、さらに慢性的な炎症状態が誘導され、そして最終的に加齢に伴う「関節リウマチ」などの慢性炎症疾患(自己免疫疾患)や発がんの発症増加、易感染性の誘発、ワクチン効率の低下につながると考えられている。
獲得免疫の仕組みの中で、老化の大きな影響を受けてしまうのがT細胞で、中でも免疫系の司令塔といわれる「ヘルパーT細胞」が免疫劣化に伴って機能的に劣化すると、免疫システム全体の機能不全を招いてしまう。しかし、免疫老化におけるヘルパーT細胞の細胞老化とそれに伴った機能異常のメカニズムはほとんどわかっていなかった。そこで山下教授らは今回、ヘルパーT細胞の細胞老化とそれに伴う機能異常のメカニズムを明らかにし、その対処法を確立することを目的に研究を実施したのである。
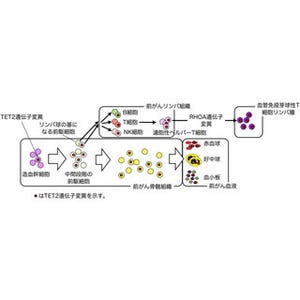
細胞の老化は、細胞は置かれた環境に応じて遺伝子配列を変化させることなく遺伝子発現の調節を行っているという「エピジェネティックな機構」で調節されていると考えられている。そのことから、山下教授らはエピジェネティック調節因子の1つである「メニン」に着目。すべてのT細胞がメニンを持たないマウスを解析し、抗原の感作(かんさ)や感染実験を行い、獲得免疫の応答が上手く誘導されないことが確認された。その原因として判明したのが、メニンを欠損したヘルパーT細胞は、活性化したのちの極めて早い時期に、細胞分裂の回数が少ないにも関わらず細胞老化を起こしていたことだ(画像1・2)。

|

|
|
メニン欠損ヘルパーT細胞は、活性化後ごく早期に細胞老化をきたす。培養皿の上で活性化させ、7日目のヘルパーT細胞における細胞老化の状態の評価が行われた。緑色は、細胞老化のマーカーである「SAβ-Gal(senescence-associated beta-galactosidase)」。野生型(画像1(左))に比べ、メニン欠損ヘルパーT細胞(画像2(右))では、SAβ-Gal活性が上昇していることがわかる |
|
細胞老化をきたした多くの細胞は、炎症性サイトカインなど、さまざまな炎症性のタンパク質を作り出して周囲に分泌し、周辺組織の炎症を引き起こし慢性化させてしまう。細胞老化により生じるこのような現象は「SASP(Senescence associated secretory phenotype)」と呼ばれ、それによって誘導される慢性的な前炎症状態は、加齢と共に増加する自己免疫疾患や代謝性疾患の発症、発がんや感染症の増加と密接に関係していると考えられている。
メニンがないヘルパーT細胞が早期に細胞老化し、SASP現象を起こしていることが認められた(画像3・4)。また、メニン欠損ヘルパーT細胞では、通常、ヘルパーT細胞の細胞老化と共に産生が増加する「インターフェロン(IFN)-γ」や「インターロイキン(IL)-4」といったエフェクター・サイトカインなどの産生が、分裂回数が少ないにも関わらず増加していることも判明。このことは、ヘルパーT細胞におけるSASPの誘導やエフェクター・サイトカインの産生が、メニンによって抑制されていることを示唆しているという。

|

|
|
メニン欠損ヘルパーT細胞では炎症性因子であるサイトカイン・ケモカインの発現が増加するSASPが認められた。画像3(左)は、炎症性サイトカイン(「IL-6」と「オステオポンチン(OPN)」)の細胞内染色を実施した後、フローサイトメトリーにより解析した結果。画像4(右)は、培養上清中の炎症性ケモカイン(「CCL-3」と「CCL-4」)量を測定したもの |
|
次に研究チームは、老化ヘルパーT細胞を人為的に作製する実験系を確立。その結果、タンパク質「バック2」がメニン下流の制御因子として同定された。正常なヘルパーT細胞では、バック2の発現はメニンにより維持されているが、細胞老化したヘルパーT細胞ではメニンの機能が低下しており、それがバック2タンパク質の減少につながっていることが突き止められたのである。
そしてバック2がメニン欠損ヘルパーT細胞に導入されたところ、細胞老化で見られるSASP誘導やエフェクター・サイトカインの産生が抑制されたこと、逆にバック2欠損ヘルパーT細胞では、メニン欠損ヘルパーT細胞と同様にSASPの誘導とエフェクター・サイトカインの産生増加が認められたことで、バック2の関与が確認された。さらなる解析が進められ、メニンはバック2遺伝子の転写・発現を維持していることも確かめられたのである(画像3)。
以上、今回の研究成果により、ヘルパーT細胞の細胞老化に伴って、メニンによるバック2の発現誘導が低下することが、SASPやエフェクター・サイトカイン産生上昇を誘導し、老化に伴った免疫機能異常を誘発し、炎症疾患の増加を引き起こす可能性が示唆されたというわけだ(画像4)。
今回の研究により、免疫老化に伴う炎症反応誘導の鍵となる分子としてメニンとバック2が同定された。最近、ほかの複数の研究チームからバック2欠損マウスでは、気道や腸管の炎症が自然発症するという報告がされている。それらの論文では、バック2が「制御性T(Treg)細胞」の恒常性維持に必要だという報告だという。山下教授らもバック2欠損ヘルパーT細胞で、Treg細胞分化に障害があることを確認済みだ(画像4)。
さらにヒトでは、バック2遺伝子の変異と、気管支喘息、関節リウマチ、多発性硬化症、クローン病、セリアック病やI型糖尿病など、多くの自己免疫疾患・慢性炎症疾患との関連も報告されている。よって、今後メニン-バック2経路による免疫システムの調節の仕組みをさらに詳細に解析し、その制御法を見つける研究を進めることで、「加齢に伴った易感染性、アレルギーや自己免疫疾患などの慢性炎症疾患の発症を予防・治療法」を確立できる可能性があるとした。