放射線医学総合研究所(NIRS)は1月3日、iPS細胞ゲノムに観察される「点突然変異」は、iPS化の過程の極初期に起きたものであることを発見したと発表した。
成果は、NIRS 研究基盤センターの杉浦真由美主任研究員(現・奈良女子大学)、笠間康次主任技術員、荒木良子室長、安倍真澄特別上席研究員らの研究チームによるもの。研究の詳細な内容は、日本時間1月3日付けで米科学誌「Stem Cell Reports」オンライン版に掲載された。
2006年に京都大学の山中伸弥教授らが開発したiPS細胞は、皮膚などの患者由来の細胞にいくつかの遺伝子を導入することにより作ることができる幹細胞であり、再生医療や創薬研究への大きな貢献が期待されている。
しかし、iPS細胞には未解明の部分も多く、がん化の問題もあり、安全性の検証は簡単ではない。その原因の1つがゲノムに生じる突然変異だ。これまでも、iPS細胞のゲノム解析が報告されているが、調べられたすべての細胞株で、多少の差はあるものの、ゲノム全体で数100から1000カ所にも上る点突然変異の存在が示唆されている(樹立法による違いは見られていない)。その内数か所はタンパク質の構造に関連する部位であったため、移植後のがん化などへの関与が懸念されているところだ。
なお点突然変異とは、ゲノムDNAの構成因子である塩基が、なんらかの理由でほかの塩基に置き換わってしまう現象のことをいう。変異がタンパク質を生むゲノム部位に生じると、そのタンパク質の機能が損なわれたり、逆に、機能が異常に促進されたりする危険性があり、それが原因で細胞が正常の状態から逸脱して増殖する、つまり、がん化を起こす場合があることが知られている。
そのため、現在では、実際に使用可能なiPS細胞の選別において、ゲノムの塩基配列解析が必要な検査項目と考えられている。しかし、検査だけでは明らかにリスクの高いiPS細胞を排除することはできても、安全性を保証することは容易なことではない。そのため、突然変異の数は可能な限り抑える必要があるというわけだ。
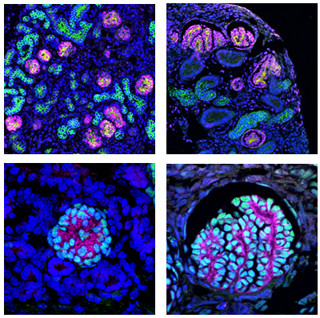
現在、これらの数100から1000個にも及ぶ点突然変異がいつ発生したものか、という点が議論されている。点突然変異の発生は以下の3点が考えられるという。1つは、iPS細胞作成前の元の細胞集団の一部に存在していたというもの。もう1つは、iPS細胞を形成する過程で生じたもの。さらに、iPS細胞の培養中に生じた可能性も考えられている。この問いは、iPS細胞の医学利用という観点からはもちろん、iPS化メカニズムの解明という観点からも極めて重要な問題だ(画像1)。
ES細胞は、あらゆる点でiPS細胞の参考にされる細胞だ。ES細胞は、受精卵からほんの少し発生が進んだ初期胚から作製する。そのため、ES細胞ゲノムの突然変異を解析する場合、父親、母親のゲノムを比較対照にする必要があるため、これまで報告がなかった。そこで研究チームは、マウスiPS細胞の点突然変異の量と質を、ES細胞のそれらと比較することにしたのである。
変異は、細胞を培養するだけで蓄積してしまうことを想定し、詳細な変異解析を実現するために、次のような注意深い準備が行われた。例えば、iPS細胞とES細胞を同じ系統のマウスから樹立する、両者の培養期間をそろえる、培養液の組成も一致させる、などだ。
ゲノムの配列の解析は、特定の領域のみでなく、なるべく広く調べるため、最新の大規模シーケンシング技術を用いて全ゲノムシーケンシング(WGS)を試み、マウスの全ゲノム約30億塩基対の内、50~60%という広い領域を解析した。その結果、検出された点突然変異の数は、iPS細胞(6株)で215~574カ所、ES細胞(4株)で13~37カ所であり、iPS細胞にはES細胞の10~20倍の点突然変異が存在することが示されたというわけだ(画像2)
続いて、それらの変異がiPS細胞を作製する時に用いた元の細胞の集団の一部にすでに存在していたかどうか、元の細胞のゲノムの該当部位も調べられた。しかし、そこに変異が存在していたという証拠は見つからなかったのである。さらに興味深いことに、iPS細胞集団に検出された変異は、ES細胞集団や、一般的に知られている細胞変異とは異なる特徴的な「塩基置換のパターン」を示した。
なお、ゲノムDNAを構成するアデニン(A)、シトシン(C)、グアニン(G)、チミン(T)の4塩基は、その構造から大きくプリン塩基(A、G)とピリミジン塩基(C、T)の2つに分類されている。一般的な突然変異は、プリン同士、ピリミジン同士の置換の方が、プリンがピリミジン、ピリミジンがプリン、に置換するより多いといわれている。今回、iPS細胞に見られた変異は、プリンがピリミジン、ピリミジンがプリンに変わるような変異が多く、一方で、ES細胞では、一般的に見られる変異パターンが多い、という結果になった。
これらの結果は、ES細胞樹立にはないステップ、つまり、iPS細胞への転換に伴って点突然変異が生じていることを強く示しているという。しかし、従来のアプローチや技術ではiPS細胞への転換時に生じた突然変異と、元の細胞にすでに存在していた突然変異を正確に見分けることは極めて困難という問題があった。
そこで研究チームが考察したのが、iPS細胞コロニー内に不均一性(異なる変異を有する細胞が存在すること)が生じているのではないかという点だ。まず、iPS細胞コロニーからゲノムを調製し、WGSの結果得られた点突然変異の存在頻度を解析したところ、この頻度が異なっていることが確認された。
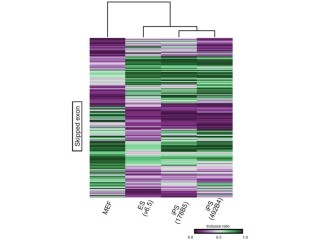
ゲノムは1つの細胞の中に父親由来と母親由来の合計2セットあり、同じ位置に同じ変異が両方のゲノムで生じることは確率的に無視できるので、コロニー内のすべての細胞に変異が存在する場合は、存在頻度50%となるが、これに加え、25%、あるいはそれ以下の頻度で存在する点突然変異が多数発見された。このような50%未満の頻度を示すものは、iPS化の前には存在しなかったものであり、iPS化直後に生じたものと考えられるという(画像3)。
さらに、1つのiPS細胞コロニー内の不均一性を確認するために、コロニーを構成する細胞を1つ1つばらばらにして、1細胞由来の細胞集団とし、それらのゲノムに存在する変異の調査も行われた。もし、変異が元の細胞ゲノムにすでに存在していたものであれば、1個1個の細胞すべてが同じ変異を有するはず、という考えである。
しかし、結果は異なった。その異なるパターンを解析すると、細胞により、変異の組み合わせのパターンがいくつかに分類できることが判明。この結果は、iPS細胞転換初期に多数の変異が生じることに加え、その変異が入った順番という変異の歴史をも確認する手掛かりとなったのである(画像3)。
今回の研究成果は、世界で初めて、iPS細胞とES細胞の突然変異の頻度の比較に成功し、またiPS細胞「転換過程」においても突然変異が生じた痕跡をとらえた形だ。今後は、研究チームが観察した現象が、より多くのiPS細胞樹立方法において確認される必要があるとする。
そして、「なぜiPS化の過程で突然変異が生じるのか」という問題を解くことが重要になるのはいうまでもない。iPS化で生じる突然変異が、ゲノム状態がリセット(初期化)され、さまざまな細胞に分化する能力を得るのに不可避な反応であるのかどうかというところも興味深い重要な問題だという。このような問題が解決できれば、突然変異を抑えるiPS細胞樹立法の確立に大きく近づくことができ、より安全な再生医療の実現が可能となるとしている。