慶應義塾大学(慶応大)は11月12日、記憶や学習といった脳機能の基盤となる機構を解明したと発表した。
成果は、慶應大 医学部生理学教室の松田信爾 専任講師、柚﨑通介 教授らの研究チームによるもの。研究の詳細な内容は、11月12日付けで英オンライン科学誌「Nature Communications」に掲載された。
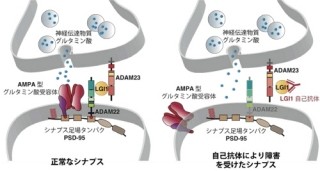
ヒトの脳は神経細胞が互いに情報を伝達しあうことで機能しているのは、説明するまでもない。そしてその神経細胞を構成するのが、「軸策」と「樹状突起」という2つの領域である。軸策は次の神経細胞の樹状突起と「シナプス」(画像1)と呼ばれる構造によって結合しており、シナプス前部から「グルタミン酸」などの神経伝達物質が放出され、それらがシナプス後部に存在する受容体に結合することによって情報は伝達される仕組みだ。この信号の伝達効率の変化は「シナプス可塑性」といい、記憶・学習の細胞レベルでの基礎過程であると考えられている。いわばシナプス(とシナプスのつながり方)こそがヒトの脳における「記憶」の場というわけだ。
神経細胞が興奮すると軸索の終末部からグルタミン酸が放出され、このグルタミン酸を次の神経細胞の樹状突起に存在するグルタミン酸受容体という膜タンパク質が受け取ることによって信号を伝える。特に、ヒトの中枢神経系において速い神経伝達を担っているのが、「AMPA型グルタミン酸受容体(AMPA受容体)」だ。
グルタミン酸とAMPA受容体による情報伝達の起きやすさは状況に応じて変化することが知られている。この現象を前述したようにシナプス可塑性といい、記憶・学習の基礎過程であると考えられているというわけだ。近年の研究結果では、樹状突起においてAMPA受容体の数が変化することこそが、シナプス可塑性の分子実体であることが明らかになっている。
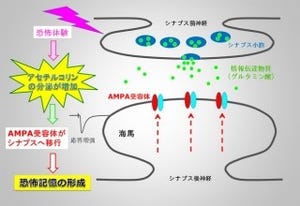
例えば、シナプス可塑性の1つである「長期抑圧(LTD:Long-Term Depression)」は、樹状突起におけるAMPA受容体の数が減少することによって、シナプスでの情報伝達の効率が長期的に低下する現象だ(画像2)。長期抑圧、つまりシナプス伝達効率の低下はAMPA受容体が細胞内へと取り込まれ、シナプス後部における受容体数の減少することによってもたらされるのである。
しかし、どのようなメカニズムによってAMPA受容体の数が制御されるのかは、実はよくわかっていない。よって、このメカニズムの解明は脳機能の理解を深めるのみではなく、さまざまな脳神経疾患の解明や治療法の開発につながることが期待されているのである。
細胞内で合成された後に細胞膜(細胞表面)へと運ばれる「膜タンパク質」は、細胞外の情報を受け取り、そして細胞内に伝達する機能を果たす。例えば、AMPA受容体はグルタミン酸と結合することによって神経細胞を興奮させるという具合だ。
細胞表面に存在する膜タンパク質の量は、細胞内から細胞膜への輸送と、細胞膜から細胞内へ取り込む速度のバランスによって精密に制御されている。この後者の過程は一般に、「AP-2」「AP-3A」と呼ばれる「アダプタータンパク質」によって制御される仕組みだ。具体的には、AP-2は細胞膜のタンパク質を細胞内へ取り込むのに必須の機能を果たす。AP-2依存的に細胞内へと取り込まれた膜タンパク質はエンドソームという細胞内小器官へ輸送される。エンドソームへ輸送された膜タンパク質の内、AP-3Aと結合するものは、タンパク質や糖を分解するさまざまな酵素が含まれている細胞内小器官「リソソーム」へと輸送されて分解されるという仕組みだ。しかし、AMPA受容体の細胞内への輸送がどのようにアダプタータンパク質によって制御されているのかについては、これまでわかっていなかった。
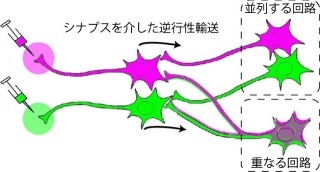
そうした状況で研究チームが今回発見したのが、AMPA受容体と強固に結合するタンパク質「Stargazin(スターゲージン)」が脱リン酸化されると、AP-2およびAP-3Aに強く結合するという事実である(画像3)。その結果、「AMPA受容体-Stargazin複合体」は細胞内へ効率よく取り込まれ、長期にわたって細胞表面のAMPA受容体の数が減少するというわけだ。
具体的には、Stargazinは長期抑圧誘導刺激により脱リン酸化され、AP-2と結合できるようになり、その結果、AMPA受容体-Stargazin複合体は細胞内へ効率よく取り込まれエンドソームへと輸送される。エンドソームでは脱リン酸化型のStargazinはAP-3Aと結合しAMPA受容体-Stargazin複合体はリソソームへと運ばれた後に分解され、長期にわたって細胞表面のAMPA受容体の数が減少するというわけだ。
また、脱リン酸化されない変異Stargazinを導入した神経細胞では、AMPA受容体の細胞内への取り込みと分解に異常が生じ、長期抑圧が起きずシナプス可塑性が障害されることが確かめられた。さらにAP-2やAP-3Aタンパク質を減少させると、AMPA受容体の神経細胞内への取り込みと分解に異常が生じることも判明。今回の研究により、これまで謎であった記憶・学習に直結するAMPA受容体の細胞内輸送機構が初めて明らかになったというわけだ。
シナプスにおいてAMPA受容体が正常に機能しないと、記憶・学習障害や神経細胞死が引き起こされることは確かめられていた。また、アルツハイマー病の原因物質の1つであるアミロイドβにより、AMPA受容体の神経細胞内への取り込みが促進するという報告もある。
従って、AMPA受容体の神経細胞内への取り込みがStargazinの脱リン酸化とアダプタータンパク質との相互作用によって制御されるという今回の発見は、神経細胞におけるシナプス可塑性の分子機構について初めて解答を与えることに成功したのみでなく、AMPA受容体が関与する認知症・虚血や神経変性疾患における神経細胞死といった病態の理解や治療法の開発につながることが期待されるとしている。