京都大学は8月12日、大阪大学(阪大)との共同研究により、メタノール資化性酵母「Pichia pastoris」より神経疾患に関連するタンパク質ファミリー「PROPPIN」の1種である「Atg18タンパク質」を精製してその性質を調べ、同タンパク質がリン酸化型と脱リン酸化型の2種類を持ち、そのリン酸化調節が「オルガネラ(細胞小器官)」の動態制御など、重要な生理機能を担っていることを明らかにしたと発表した。
成果は、京大農学研究科の阪井康能教授、同・奥公秀助教、阪大タンパク質研究所の田村直輝ポストドクターらの共同研究チームによるもの。研究の詳細な内容は、米国東部時間8月12日付けで米科学誌「Journal of Cell Biology」誌オンライン版に掲載された。
Atg18は、酵母から高等生物にまで広く保存されているタンパク質ファミリーのPROPPINの1種だ。細胞内で膜に結合したり離れたりしながら、「オートファジー(自食作用)」に関わっているが、どのようにしてそのダイナミクスが調節されているのかはわかっていなかった。
最近、ヒトでは同じくPROPPINの1種である「WIPI4」(Atg18のホモログ(相同体))がうまく働かなくなるとオートファジーが進まなくなり、神経疾患の1種である「脳内鉄沈着神経変性症」を引き起こすこと、酵母やカビなどの真核微生物では植物葉上などの自然界やヒトや植物への感染時に増殖する時にオートファジーが必要で、地球温暖化に大きな影響を及ぼす炭素循環や食糧生産に重要な役割を果たしていることなどが発表されている。
今回の研究により、Atg18がリン酸化型と脱リン酸化型の2種類を持っていることが判明したが、そのリン酸化に関してはヒトでも起こっていることが予測されていた。しかし、リン酸化型に比較すると脱リン酸化型Atg18では、生体膜中に含まれるシグナルリン脂質「PI(3,5)P2」への親和性が高いことが判明したのである。
またAtg18のどこがリン酸化されるのか、そのアミノ酸残基と立体的な位置が決定され、膜との結合性が調べられたところ、Atg18がリン酸化されるとどうしてPI(3,5)P2を含む生体膜に結合しにくくなるのかについて、膜とタンパク質の立体構造から解明することに成功した。
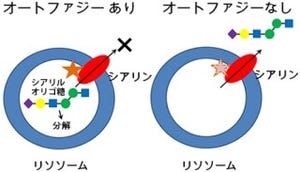
タンパク質のリン酸化は細胞内の情報伝達で重要な働きをしていることがわかっているが、今回の成果は、生体膜上のリン脂質の質や量ではなく、タンパク質のリン酸化が生体膜との相互作用を、直接、調節していることを示した初めての例である。このように細胞内ではAtg18タンパク質のリン酸化を調節することで、生体膜への親和性が調節され、くっついたり離れたりしていることがわかったというわけだ。
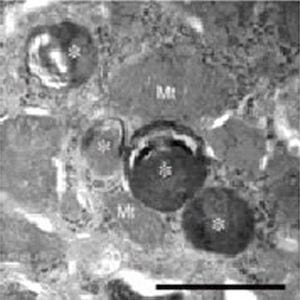
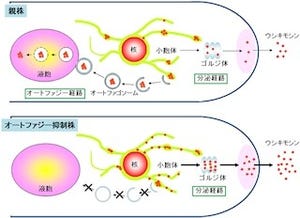
またAtg18のリン酸化制御が、酵母ではオルガネラの1つである液胞の形を制御していることも示された。オートファジーの1種である「ミクロオートファジー」では、液胞が別のオルガネラである「ペルオキシソーム」を分裂しながら大きく包み込んでいくが、Atg18を欠損させると、このような液胞の形態変化が起きなくなることがわかった。
また、高浸透圧条件では液胞は分裂によりその数を増やしていくが、低浸透圧条件ではいくつかの液胞は融合しながら大きくなる。Atg18がリン酸化されるとAtg18は液胞膜から離れてオートファジーにおけるオートファゴソーム膜の形成に働く。
一方、Atg18が脱リン酸化されるとAtg18は液胞膜に結合して液胞の分裂を引き起こすことも判明。自然界にさらされる酵母はAtg18のリン酸化を調節することで、液胞形態を変化させて浸透圧変化への対応とオートファジー活性の調節を行っていることも確認された。これらの結果から、同様のAtg18のリン酸化による調節がヒトの細胞でも起こっている可能性があるとしている。
Atg18のリン酸化と細胞内で働く時の動態メカニズムが新たにわかったことで、今後、オートファジーやオルガネラの細胞内ダイナミクスが、どのように調節されているかについての理解が進むという。それにより、オートファジーやその調節がうまくいかないことに起因する疾患・植物病原菌の感染や共生の新たなメカニズムの解明、Atg18を含む疾患に関わるPROPPIN分子・Atg分子のリン酸化・脱リン酸化をターゲットとした新たな治療薬の開発が可能になったと考えられるとしている。