福岡大学と理化学研究所(理研)は6月8日、膵島細胞移植の際におこる拒絶反応に対し、従来のレシピエントの免疫反応を制御する治療とは異なり、移植するドナー膵島を標的にした副作用のない新たな治療法を開発したと発表した。
同成果は、同大医学部再生・移植医学の安波洋一 教授と理研 統合生命医科学研究センター免疫制御戦略研究グループの谷口克グループディレクターらによるもの。詳細は、米国移植学会誌「American Journal of Transplantation」(オンライン版)に掲載された。
日本国内の糖尿病患者の数は約890万人とも言われ、中でも重症糖尿病患者である約10万人は、生涯にわたってインスリンを注射し続けなければならないという。
そうしたインスリン注射を不要にする治療法として、インスリンを作る膵島細胞を糖尿病患者の肝臓内に移植し、永久に生着させ、糖尿病を完治させるという方法があり、全世界で、2000年から2012年までの間に約700例の膵島細胞移植が行われてきたが、膵島細胞提供者の数が限られており、膵島細胞の不足が深刻な問題となっている。
また、免疫抑制剤を使用しても、移植後数時間で起こる早期拒絶反応によって、移植した膵島細胞が破壊されるため、1人から採取した膵島細胞すべてを移植しても治療効果は得られず、2~3回の移植(2~3人分)を1人に移植しないと治療効果が得られないため、こうした課題を解決する新たな治療法の開発が求められるようになっている。
研究グループはこれまでの研究から、膵島細胞移植直後におこる早期拒絶反応が、膵島細胞自身から細胞外に放出される核内タンパク質「HMGB1」によって引き起こされることを報告してきた。HMGB1は、免疫細胞であるNKT細胞ならびに、移植が引き金となって集まってきた多形核白血球を活性化して、早期移植拒絶を引き起こすことが知られているが、移植された膵島細胞からどのような機序でHMGB1が放出されるのかは不明のままであり、このメカニズムを解明することで、効果的な早期拒絶反応の制御法開発に繋がることが期待されていた。
研究グループは今回、移植直後の膵島細胞は新たに血管ができるまで低酸素状態に曝され、そのことが引き金となり、膵島細胞膜に存在するNa+/Ca2+交換体(NCX)を介してカルシウムが細胞内に流入し、膵島細胞障害がおこり、それによってHMGB1が放出されるというメカニズムを突き止めた。
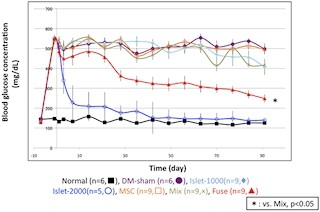
また、ドナー膵島細胞のNCXを移植前の培養中に添加した阻害剤でブロックした後に移植すると、カルシウムが膵島細胞に流入せず、移植膵島障害が回避されることとなり、結果として、HMGB1が放出されず、早期拒絶反応が起こらないことを見出したという。
同方法は、従来の免疫抑制剤のように移植を受けるレシピエントを対象にした治療法ではなく、移植するドナー膵島を標的にした拒絶反応制御法であるため、レシピエントへの副作用がなく、安全で体に優しい治療法となると研究グループでは説明している。
なお、研究グループでは、今回の拒絶反応制御法について、ヒト膵島を糖尿病マウスに移植した実験での有効性も確認しており、実際のレシピエントへの膵島移植での効果が期待できるとしており、これにより、インスリン注射に代わる重症糖尿病の根本的治療法の確立に向けた技術開発につながることが期待されるとしている。