理化学研究所(理研)と東京大学のは4月5日、米イェール大学との国際共同研究により、バクテリアにおける「21番目のアミノ酸」と呼ばれる「セレノシステイン(Sec)」の合成メカニズムを解明したと共同で発表した。
成果は、理研 生命分子システム基盤研究領域の横山茂之領域長(現・横山構造生物学研究室 上席研究員)、東大 分子細胞生物学研究所の伊藤弓弦助教らの研究チームによるもの。研究の詳細な内容は、米科学雑誌「Science」4月5日号に掲載された。
原子番号34のセレン(Se)は、周期表の酸素(原子番号8)と硫黄(原子番号16)の下に位置し、硫黄と似た性質を持つが、より反応性に富んでいるという特徴を持つ。そのため、ヒトからバクテリアに至る幅広い生物にとって微量成分として不可欠であり、Seが欠乏すると、がんや高血圧症を引き起こしてしまう。生体内では主にアミノ酸のセレノシステインに存在し、一部のタンパク質(Se含有タンパク質)に取り込まれる。Se含有タンパク質はSeの高い反応性を利用して、抗酸化作用など重要な機能を発揮する仕組みだ。
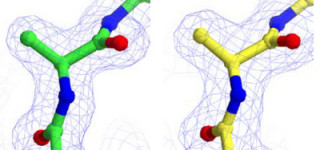
セレノシステインは、タンパク質を構成する標準的な20種類のアミノ酸に加え、新たな21番目のアミノ酸として知られている(画像1)。標準的なアミノ酸と同様に、遺伝暗号に従ってタンパク質に取り込まれていく仕組みだ。その際、アミノ酸をタンパク質合成の場である細胞内小器官の「リボソーム」に運搬するには、それぞれ専用の運搬役のtRNA(transfer RNA:転移RNA)が必要で、セレノシステインには専用のtRNASecが存在する。通常のtRNAは、それぞれに対応するアミノ酸が結合するが、tRNASecは、まず1度別のアミノ酸である「セリン(Ser)」(画像1)が結合する(Ser-tRNASec)。その後、セリンがセレノシステインへ変換され、Sec-tRNASecが合成されて、リボソームに運搬されることでタンパク質に取り込まれるという流れだ(画像2)。
この変換メカニズムは、ヒトを含めた真核生物とアーキア(古細菌)のグループ(真核生物/アーキア型(ヒト型))とバクテリアのグループ(バクテリア型)ではまったく異なるのは、画像2の通りである。ヒト型では、2つの酵素「PSTK」と「SepSecS」によって、2段階でセリンからセレノシステインへと変換される仕組みだ。詳しくは、PSTKがSer-tRNASecを識別し、セリンにリン酸基(P)を転移して目印とし、次にSepSecSが目印のあるセリンだけをセレノシステインに変換するという流れだ(画像2・上)。
一方、バクテリアでは1つの酵素「SelA」によって、1段階でセリンをセレノシステインに変換する(画像2・中)。2010年に研究チームの成果などにより、ヒト型のメカニズムの全容が明らかになったが、バクテリア型のメカニズムの研究は巨大タンパク質であるSelAの結晶構造解析が技術的に困難であったため大きく遅れており、その解明が求められていたというわけだ。
そこで研究チームは、バクテリアの1種である「A.aeolicus(A.アエオリカス)」由来のSelA単体、およびSelAとtRNASecの複合体の結晶を作製し、理研が所有する大型放射光施設「SPring-8」のビームライン「BL41XU」と、高エネルギー加速器研究機構(KEK)の放射光科学研究施設「フォトンファクトリー」のビームライン「BL5A」、「BL17A」、「NW12A」を用いて結晶構造の解析を実施した。
その結果、SelAは2個のサブユニットからなる2量体が5個、星形に配列した10量体であることがわかったのである(画像3)。すべてのサブユニットは互いに同じ構造であるため、正5角形型の対称性を持つ。正5角形型の正面から見た図が画像3(左)で、側面から見た図が画像3(右)だ。N末端ドメインが星型の板状構造から突き出しているのが特徴である。この正五角形は10個のサブユニットが環状に配置した構造で、10個ある触媒ポケットには、酵素の働きを助ける補酵素の1種「ピリドキサールリン酸(PLP)」が結合している。PLPはビタミンB6が体内で形を変えたもので、SelAのほか、さまざまな酵素の活性を担う存在だ。
そしてSelAの分子量は、通常のタンパク質が数万であるのに対し、50万を超える点が大きな特徴である。具体的には、SelAとtRNASecの複合体では、合計10個のtRNASecがSelAに結合しており、総分子量81万の超巨大タンパク質-RNA複合体を形成しているのだ(画像4)。この大きさは、すべての細胞に存在するタンパク質合成の場であるリボソームを構成する2つの粒子の小型の方である「30S粒子」(大型は「50S粒子」と呼ばれる)も匹敵するサイズである。
また、SelAと共通の先祖を持つほかの酵素は、2量体か4量体で機能しているのに対し、SelAは10量体であり、このような巨大な構造はほかに例がない。
そこで研究チームが次に取り組んだのが、なぜ超巨大な複合体が必要なのか、その詳細な機能についての調査であった。その結果、SelAの中で、隣り合う2個の2量体に含まれる4個のサブユニットA~D(画像5・6)は、1つのSer-tRNASecに対し、協力して4つの異なる作業を担うことがわかったのである。サブユニットAのN末端ドメインがtRNASecの特徴的なDアームと結合してtRNASecを識別している仕組みだ。
具体的には、サブユニットAが(1)「Ser-tRNASecを識別し」、サブユニットAとBが(2)「Ser-tRNASecを固定し」、サブユニットCが(3)「Ser-tRNASecの先端をつかまえ」、サブユニットCとDが(4)「その先端にあるセリンをセレノシステインへと変換する」、という連続した作業により、1段階でセリンをセレノシステインに変換するとわかった。
なお、サブユニットはすべて同じ構造であるため、隣のSer-tRNASecに対しては、サブユニットCが(1)を、サブユニットCとDが(2)を、サブユニットEが(3)を、サブユニットEとFが(4)を担う。また、向かい合うSer-tRNASecに対しては、サブユニットDが(1)を、サブユニットDとCが(2)を、サブユニットBが(3)を、サブユニットBとAが(4)を担う、というように、各サブユニットは4つの作業をすべて担うことができる。
これらのサブユニットをそれぞれのtRNASecに対して機能させるためには、2量体の配置が重要であり、これを実現するためにバクテリアでは、超巨大な正5角形型の星形構造を産み出したことが判明した。さらに、環状に5つの2量体を配置することで、全体では(1)~(4)の作業が10カ所で可能である。もし、直線状に配置した場合は、両端に無駄ができるため、全体で8カ所だけとなり非効率的だ。このように環状であることの重要性も判明した(画像5・6)。
また、セリンからセレノシステインへの変換は、反応性に富むSeを組み込む困難な反応であると共に、tRNASerなどほかのtRNAにSeを導入しないよう、正確に識別する必要がある。そのメカニズムを詳細に調べたところ、SelAは、星型の構造から突出した領域(N末端ドメイン:画像3・右、画像5)が、tRNASecが持つ固有のDアームと結合することで、tRNASecを正確に識別しているとわかった(画像7)。
さらに、ヒト型で働くSepSecSとバクテリア型で働くSelAでは、セリンからセレノシステインへの変換を触媒する部位の構造がまったく異なることも判明。セレノシステインを合成するこれらの酵素は、互いの構造も反応メカニズムも異なる。つまり、ヒト型とバクテリア型の酵素は、別々の先祖から、それぞれ独立にセレノシステインを合成できるように進化(収れん進化)したという非常に興味深いこともわかったというわけだ。
Se含有タンパク質は、ヒトの生存や健康の維持に必須で、その研究は大変重要だ。しかし現状では、セレノシステインを自在にタンパク質へ取り込むことができないため、人工的な合成は困難である。しかし研究チームは今回、ヒト型に続きバクテリア型の生体内のセレノシステイン合成メカニズムの解明にも成功した形だ。今後、人工的なSe含有タンパク質合成方法の開発に貢献し、Seの自在な導入によって今までできなかった天然の酵素の機能を上回る能力を持つスーパー酵素の創生や、Se欠乏を原因とする疾患の研究などに役立つことが期待できるという。
またアーキアとバクテリアの多くは、基本的な20種類のアミノ酸の内の幾つかについても、セレノシステイン合成のようにtRNA上でほかのアミノ酸を経由して合成を行っているという特徴を持つ。これは原始生物の名残とされ、初期の生物は少ない種類のアミノ酸からタンパク質を合成し、進化の過程で新しいアミノ酸を獲得していったと考えられているのである。
タンパク質を構成するアミノ酸の並びはDNA上の遺伝子に規定されているため、新規のアミノ酸の獲得には遺伝暗号とその翻訳系の進化が必要だ。セレノシステインの翻訳系は最も歴史の浅い未熟なものであるため、セレノシステインの合成から組み込みまでのメカニズムを詳細に調べ、完成されたアミノ酸の翻訳系と比較することは、原始の生物が遺伝暗号を進化させながら現在の姿に至った経緯をひも解く手がかりになると期待できると、研究チームはコメントしている。