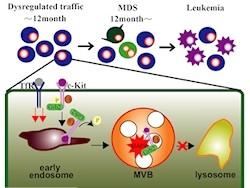
東北大学は2月26日、輸送小胞の1つである「クラスリン小胞」の形成を調節する「smap1遺伝子」を欠損させたマウスが12カ月齢以降の高齢になると、ヒトの重篤な血液疾患である「骨髄異形成症候群(MDS)」を発症し、一部は「急性白血病」に移行することを見出したと発表した。
成果は、東北大 免疫遺伝子制御分野の佐竹正延教授、同・昆俊亮助教らの研究グループによるもの。研究の詳細な内容は、米国東部時間2月22日付け米科学雑誌で「The Journal of Clinical Investigation」電子版に先行掲載され、印刷版3月号では注目研究「JCI Impact」に取り上げられる予定だ。
真核細胞内では、さまざまな細胞内小器官が独立に配置され、整然と機能している。小器官の間では、精緻な物流ネットワーク(細胞内輸送)が張り巡らされており、輸送される積み荷分子は小胞と呼ばれる構造体にパッケージングされる仕組みだ。
この細胞内輸送機構はがんとの関連が長い間示唆されており、輸送機構の破綻が発がんにつながるとされていたが、科学的根拠が乏しい状況が続いていた。そこで研究グループは今回、smap1欠損マウスを作製し解明に向けた実験を行った。
その結果、12カ月齢以降の高齢なsmap1遺伝子欠損マウスでは、血液疾患のMDSを発症し、一部が急性白血病に移行することが確認された。
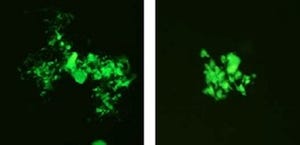
そこで、分子機序の解明を進めたところ、smap1欠損血液細胞で、血清中の鉄を細胞内へと供給する「トランスフェリン受容体(TfR)」の取り込みが亢進していること、また増殖因子受容体である「c-Kit」の細胞内輸送が障害されることでその分解が遅延し、それに伴ってc-Kitシグナルが増大・継続していることが判明したという。
今回の実験は、TfRやc-Kitの輸送異常に代表されるクラスリン輸送系の脱制御が素因となってMDSならびに白血病が引き起こされることを、個体レベルで実証したものであり、研究グループでは今回の成果から、smap1欠損マウスがMDSの治療戦略・探索のツールになり得ることが示されたほか、造血器腫瘍をはじめ、輸送関連分子の機能異常が想定されている悪性腫瘍の詳細な解析を進めることが可能になるものとの期待を示している。