東京都医学総合研究所と東京都福祉保健局は、難病「ALS(筋萎縮性側索硬化症)」や「若年性認知症」の患者の脳や脊髄に蓄積するタンパク質「TDP-43(TAR DNA binding protein of 43kDa)」の構造異常の違いがその患者の病型を決めていることを明らかと発表した。
成果は、長谷川成人参事研究員を中心とした、筑波大学神経内科、東京都健康長寿医療センター、愛知医科大学、国立精神・神経医療研究センター、マンチェスター大学らとの共同研究によるもの。研究の詳細な内容は、英国時間9月11日付けで英国科学雑誌「Brain」オンライン版に掲載された。
ALSは運動ニューロンの変性により筋肉の萎縮と筋力低下をきたす神経変性疾患である。また若年性認知症の主要なタイプである「前頭側頭葉変性症」は、脳の前頭葉や側頭葉が強く冒され、萎縮する疾患だ。
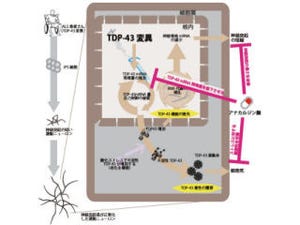
これらの疾患では、正常では細胞の核に存在するタンパク質のTDP-43が神経細胞やその突起、あるいは核内に異常な構造物を形成して蓄積すること、またそれが神経細胞の変性に深く関与していることが示されている。
TDP-43はこれら以外のさまざまな認知症疾患、例えばアルツハイマー病などにも蓄積することが確認済みだ。その異常構造物の形態から主に4種類に分類されている。しかし疾患のタイプによって、蓄積する異常TDP-43の性質が本当に違うかどうか、また1人の患者において、脳や脊髄の異なる部位に蓄積した異常TDP-43の性質が常に同じかどうか、などについては不明だった。
そこで研究グループは今回、ALS、若年性認知症、さらにはアルツハイマー病などの多数例の患者の脳脊髄に蓄積するTDP-43を、特異的抗体などを用いて生化学的に検討。
その結果、病気の種類、タイプ(病型)ごとに蓄積する異常なTDP-43の生化学的特徴が異なること、また1人の患者について調べて見ると、脳や脊髄のどこの部位を調べても必ず同じ特徴を持つ異常TDP-43が蓄積していることが見出された。
それぞれの異常TDP-43の違いは、異常プリオンを検出する場合によく用いられる「プロテアーゼ耐性バンド」を比較する方法を用いると、より明確になることから、TDP-43の構造異常の違いがその患者の病型を決めていることが示されたのである。
また、TDP-43は複数の異常構造を取り得るにも関わらず、1人の患者では同じ(単一の)異常構造しか見られないことから、1カ所で生じた異常TDP-43が、プリオン病の場合と似たメカニズムで、正常TDP-43を異常TDP-43に次々と変質させて脳や脊髄全体に広がり、病気が進行すると考えられるという。
今回の結果は実際の疾患脳脊髄を解析して得られた知見なので、実験室モデルの解析からの推測とは異なり、ヒトの病気で起きている現象そのものを直接明らかにした形だ。
病気の発症原因だけでなく、進行機序を考える上で重要な意味を持っているといえるだろう。すなわち、この異常なTDP-43が正常なTDP-43を変質させて広がるプロセスを阻害する薬剤や治療法を開発することで、これら難病の根本治療が可能になると考えられると、研究グループはコメントしている。