北海道大学(北大)は12月20日、抑制性シナプスの形成部位との発現制御の関係がほとんどわかっていなかった塩素イオンの細胞外排出を行う輸送体「KCC2」について、小脳の「プルキンエ細胞」に着目して発現解析を実施したところ、発達期と成体期の同細胞で異なる発現調節の仕組みが確認され、KCC2が特定の抑制性シナプスの抑制作用を調節することで興奮と抑制のバランスを図る分子機構であることが明らかになったと発表した。
成果は、北大大学院 医学研究科の渡辺雅彦教授らの研究グループによるもの。正確には、同・医学部医学科学生の河北一誠氏が3年次からこの研究に着手し、医学研究科解剖発生学分野のスタッフの指導と助言を受けながら、卒業を迎えた6年次にまとめ上げた研究論文である。研究の詳細な内容は、12月6日付けで欧州神経科学誌「European Journal of Neuroscience」のオンライン速報版に掲載された。
ニューロンにおける塩素イオンの濃度勾配の形成と維持は、抑制性伝達物質の抑制作用の強度を規定し、生命機能の維持や正常な神経機能発現に不可欠だ。KCC2は塩素イオンの細胞外排出に関わるイオン輸送体で、生後に発達していくにつれてニューロンでの発現が高まり、これに伴いニューロン内の塩素イオン濃度を低下させる。
この濃度低下により、「GABA」や「グリシン」などの抑制性伝達物質がシナプスに働くと細胞内に塩素イオンが流入し、強い抑制作用を発揮できるようになる仕組みだ。
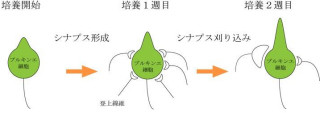
小脳の中心的ニューロンであるプルキンエ細胞は、器用で円滑な運動を可能にする小脳の中心的ニューロンだ。このニューロンを支配して興奮作用を発揮する「登上線維」の支配様式は、複数の線維が支配する発達段階の多重支配から、1本の線維による単一支配へと移行する。
多重支配期には、複数の登上線維がプルキンエ細胞の細胞体を取り囲んで密にシナプスを形成し、互いに競合し合う。やがて、その中から1本の勝者が樹状突起へと駆け上がって神経支配を確立し、ほかの敗者は細胞体から除去されて単一支配が完成するというわけだ。
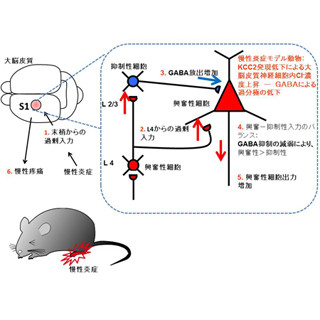
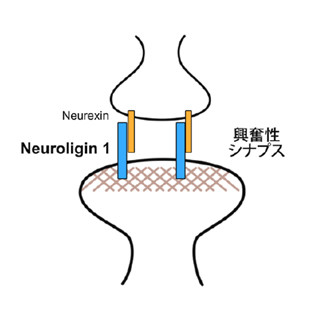
この発達期において、登上線維シナプスの強い興奮作用と対抗する抑制性シナプスは「バスケット細胞」であり、その抑制作用により細胞体の登上線維シナプスを除去する(画像1・左)。
ただしこれが、成熟して登上線維シナプスが細胞体から樹状突起へと移動する成体期になると変化し、KCC2の強い発現は細胞体から消失し、「星状細胞」が抑制性シナプスを形成する樹状突起領域へとシフトする(画像1・右)。
抑制性シナプスの形成部位とKCC2の発現制御との関係はこれまでほとんど不明だったことから、今回の研究では、このようにシナプス回路の発達成熟過程が最もよくわかっているプルキンエ細胞を材料にして、KCC2の発現がシナプス回路発達とどのように連動して制御されているのかが探られることとなった次第だ。
まず、KCC2の発現検出に必要なKCC2に対する特異的抗体を作成。次に、これを用いて出生時から成体期に至るまでのマウスの小脳のプルキンエ細胞におけるKCC2のタンパク質レベルでの時空間的発現変化を、光学顕微鏡および電子顕微鏡レベルで解析した。
プルキンエ細胞の細胞体が、興奮性の登上線維シナプスと抑制性のバスケット細胞シナプスが密集する発達期では、KCC2は細胞体上の登上線維シナプスに著明な集積を示した(画像2・3)。
|
|
|
|
画像2。生後7日齢マウスのプルキンエ細胞。金属粒子は、登上線維シナプスに集積するKCC2を示す |
画像3。生後10日齢マウスのプルキンエ細胞。登上線維シナプス(矢印、緑)の周囲に終結するKCC2(赤)。屋頭はバスケット細胞シナプス(青) |
この登上線維シナプスに関連したKCC2の細胞体集積は、やがてこれと入れ替わるバスケット細胞シナプスによる抑制作用を強化し、登上線維による単一支配化を加速するものと考えられる。
一方、登上線維の単一支配が確立しそのシナプスが細胞体から樹状突起に移動する成体期になると、細胞体での強いKCC2の集積は消失し、強い発現部位は星状細胞による抑制性シナプスが配置する樹状突起領域となった。
このような発達期と成体期で異なる抑制性ニューロンに関連したKCC2の発現調節は、特定の抑制性伝達を選択的に強化し維持する分子機能を反映し、これにより調和の取れた興奮と抑制を作り出す機構であると理解することができる。
発達期の登上線維シナプスへの集積は、KCC2の発現が神経活動に依存して調節されていることを示唆し、興奮の高まりが次に抑制力の強化を導くことで脳の恒常性を維持していると考えられるという。
さらに、抑制性伝達物質によるニューロンネットワークの形成と機能が脳の発達や機能発現において重要であることを考え合わせると、KCC2発現調節の分子細胞機構の解明とそれを標的とした創薬が、発達障害やてんかんなどの発生機序の解明や新たな治療法の開発につながることも期待されるとしている。