東京大学(東大)と群馬大学(群大)は、産業技術総合研究所、カリフォルニア大学サンフランシスコ校、京都大学の協力を得て、血液がんである「B細胞リンパ腫」の内で日本人に多く見られるタイプの悪性リンパ腫「非ホジキンリンパ腫」の発症メカニズムの一端を解明したと共同で発表した。
成果は、東大大学院理学研究科の濡木理教授、群大生体調節研究所の徳永文稔教授らの共同研究グループによるもの。研究の詳細な内容は、8月28日付けで学術誌「The EMBO Journal」オンライン版に掲載され、印刷版の10月3日号にも掲載される予定だ。
タンパク質「NF-κB」は1986年にDavid Baltimore(米国の生化学者、1975年度ノーベル生理学医学賞受賞者)らによって発見された「転写因子」で、炎症応答や免疫制御、細胞の生存、がん細胞の接着・浸潤などに関与する多くの遺伝子の発現を調節する。
したがって、NF-κBの調節が異常となることは、多くのがんや、クローン病、関節リウマチ、乾癬などの慢性炎症性自己免疫疾患、糖尿病など生活習慣病の発症や病状の進行に多大に影響してしまう。
NF-κBは通常、免疫細胞の細胞質に存在するが、免疫細胞がストレスに曝されると核内へ移行し、標的遺伝子の発現を誘導する。この過程で「ユビキチン化」などの翻訳後修飾が重要な役割を果たす。
ユビキチンは真核生物に高度に保存された小球状タンパク質で、Avram Hershko(イスラエルの生化学者、2004年度ノーベル化学賞受賞)らによって、不要タンパク質に結合することで、その不要タンパク質を分解へと導く標識分子として発見された。
その後の研究から、ユビキチンは数珠状に連結して7種の「分岐鎖状ポリユビキチン」を形成し、タンパク質分解のみならず、DNA修復やシグナル伝達、細胞内輸送など多彩な生理機能に関与することが明らかになっている。
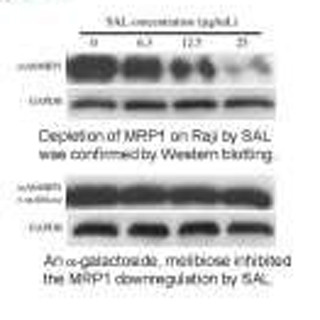
2006年に徳永教授らは、これまでに見出されていた7種の分岐鎖状ユビキチンに加えて、ユビキチンリガーゼ複合体「LUBAC」により生成される「直鎖状ユビキチン」がNF-κB経路を活性化することを発見した(画像1)。
LUBACは、NF-κBの活性化因子である「IκBキナーゼ(IKK)複合体」に直鎖状ユビキチンを結合させることでIKKを活性化し、そしてNF-κB経路を活性化させる。このLUBACによって活性化されたNF-κB経路は、その一方で適切なタイミングで抑制される必要があるが、その分子機構は不明だった。
画像1は、LUBACによる直鎖状ユビキチン生成を介したNF-κB経路の活性化機構の模式図。各種刺激を「TNF(tumor necrosis factor:腫瘍壊死因子)受容体」が感知すると、細胞質でLUBACがIKK複合体に直鎖状ユビキチンを付加し、IKKを活性化。活性化したIKKはNF-κBの阻害タンパク質を分解に導き、フリーになったNF-κBは核内へ移行して遺伝子の発現を誘導するという仕組みである。
なおTNF受容体とは、炎症性サイトカイン「TNF-α」に結合してそのシグナルを細胞内に伝達する受容体で、NF-κB経路や細胞死(アポトーシス)の調節を行う。
LUBAC活性にブレーキを掛ける候補分子として3つのユビキチン分解酵素(脱ユビキチン化酵素)が調べられた。すると、脱ユビキチン化酵素「A20」がLUBACによるNF-κB経路の活性化を強く抑制することが見出されたのである。
しかし予想外なことに、A20には直鎖状ユビキチンを分解する活性はなかったのだ。A20は脱ユビキチン化酵素部分と7つの「ジンクフィンガー」からなるタンパク質だ。なお、ジンクフィンガーとは、亜鉛イオンを含むタンパク質ドメインの1種で、DNA結合やタンパク質結合など多様な生理機能を持つ。
そこで、A20のどの部分がどのようにしてNF-κB経路の抑制に働くか調べたところ、A20は7番目のジンクフィンガー「ZF7」を介して直鎖状ユビキチンに結合し、NF-κB経路を抑制することがわかった。
さらにX線結晶構造解析により、ZF7は直鎖状ユビキチンの2つのユビキチン分子を同時に認識し、直鎖状ユビキチンに特異的に結合することも判明したのである(画像2)。
免疫細胞でNF-κB経路が活性化されると、ブレーキタンパク質であるA20が生成。そしてA20が、IKKやLUBACを含むTNF受容体複合体に集積してNF-κB経路が抑制される。
そこで、直鎖状ユビキチンと結合できないZF7を持つA20変異体を作製し解析したところ、A20はZF7を介して直鎖状ユビキチンと結合することでTNF受容体複合体に集積し、NF-κBの活性化を抑制することが明らかとなった(画像3)。
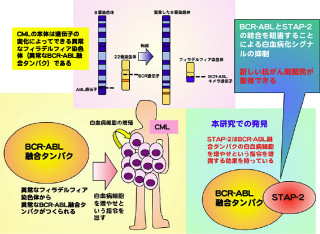
画像3は、A20による直鎖状ユビキチン結合を介したNF-κB抑制機構とB細胞リンパ腫との関連を表した模式図だ。正常な細胞では、NF-κB活性化の後A20が発現し、A20はZF7を介して直鎖状ユビキチンに結合することで、適切なタイミングでNF-κB経路を抑制する。
一方、ZF7に異常があるとA20は直鎖状ユビキチンに結合できず、NF-κB経路にブレーキが掛からない。このため、持続的なNF-κB活性亢進状態になり、発がんに至ると考えられるという。

|

|
|
画像2。A20ZF7と直鎖状ユビキチンとの共結晶構造。A20のZF7は直鎖状に結合した遠位ユビキチンと近位ユビキチンの両方を同時に認識して結合する |
画像3。A20による直鎖状ユビキチン結合を介したNF-κB抑制機構とB細胞リンパ腫との関連 |
A20の遺伝子多型は関節リウマチ、全身性エリテマトーデス、乾癬、糖尿病など多くの病態と関連している。さらに、ZF7の欠損やアミノ酸変異は、B細胞リンパ腫(ホジキン・非ホジキンリンパ腫)を惹起してしまう。
そこで、非ホジキンリンパ腫を引き起こすZF7のアミノ酸変異を持つA20変異体を解析したところ、これらの変異体では直鎖状ユビキチンとの結合が弱くなり、免疫細胞への刺激によって引き起こされる、A20のTNF受容体複合体への集積も低下していることが判明した。
以上の結果から、ZF7の欠損や変異により直鎖状ユビキチンへの結合力が弱くなると、A20のTNF受容体複合体への集積が不全となり、NF-κBが活性化された状態が持続することで病態発症につながることが示唆されたのである(画像3)。
B細胞リンパ腫は血液のがん、悪性リンパ腫の1種で、ホジキンリンパ腫と非ホジキンリンパ腫に大別されるが、日本では非ホジキンリンパ腫が多い。治療には4つの薬剤を併用する化学療法(CHOP療法)や分子標的薬リツキシマブ(ヒト化抗CD20抗体)が用いられているが、今なお治療困難なケースが多く見られる。
今回の研究から、非ホジキンリンパ腫の発症にはA20のZF7の直鎖状ユビキチンへの結合が関与するという新たな知見が得られ、その発症メカニズムの一端が解明された形だ。
直鎖状ユビキチンはNF-κB経路の活性化の足場として重要だが、ブレーキタンパク質であるA20が集積する足場としても極めて重要であることが、今回初めて明らかになった。
従って、直鎖状ユビキチンを標的とする薬剤はNF-κB経路を特異的かつ有効に抑制すると期待され、抗がん剤や自己免疫疾患治療薬の創薬シーズとして有用と考えられると、研究グループはコメントしている。