分子科学研究所(IMS)は8月7日、理化学研究所(理研)の所有する大型放射光施設「SPring-8」を活用して、生命維持に不可欠な金属元素である鉄を含む化合物「ヘム」の細胞内濃度を調節するタンパク質を特定し、ヘム濃度を一定に保つための仕組みを原子レベルで明らかにしたと発表した。
成果は、IMS 岡崎統合バイオサイエンスセンターの青野重利教授、理研播磨研究所 放射光科学総合研究センターの城宜嗣主任研究員らの研究グループによるもの。研究の詳細な内容は、7月13日付けで米国生化学および分子生物学会発行の生物科学系学雑誌「Journal of Biological Chemistry」に掲載された。
ヒトの細胞内では、鉄を含む化合物であるヘムがタンパク質と結合することにより、酸素の運搬貯蔵などの多様な生理機能を発揮している。その一方で、タンパク質に結合していない遊離のヘムは、活性酸素を発生させるなどの働きがあり、細胞にとっては猛毒となってしまう一面を持つ。
そこで生物の多くは、遊離ヘムによる毒性を抑えるために、細胞内のヘム濃度を厳密に制御するシステムを備えるよう進化してきた。しかし、細胞内ヘム濃度を一定に保つための仕組みは、すべての生物で未解明だったのである。
研究グループは今回、チーズなどの発酵乳製品製造で用いられる乳酸菌をモデル生物として選択した。乳酸菌を選択した理由は、乳酸菌がヘムを菌体内で合成することはできないが、外から取り込んでそれを用いた生理機能を発揮できる仕組みを有しているからだ。
そこで、生化学的な実験やX線結晶構造解析により、有毒な遊離ヘムを感知して細胞外へ排出するためのスイッチとして働くタンパク質を探し、細胞内ヘム濃度を一定に保つシステムの詳細を明らかにするための研究が進められた。
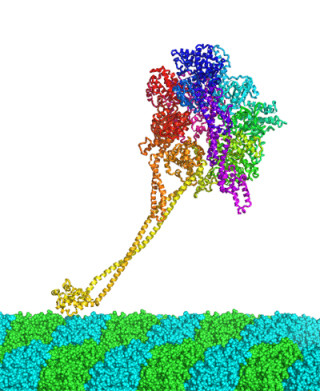
乳酸菌の細胞内には、遊離ヘムを感知するヘムセンサタンパク質が存在する。このタンパク質がヘム濃度を一定に保つシステムのスイッチとして働くことが明らかになったのである(画像1)。
このタンパク質は、ヘムを取り込んでいない時は、ヘムを細胞外へ排出するための「ヘム排出遺伝子」と結合して働かないようにしているという特性を持つ。しかし、ヘム濃度が高くセンサタンパク質がヘムを取り込むようになると、このタンパク質は遺伝子から外れて、ヘム排出の働きがオンになる。
このセンサタンパク質がスイッチとして働く仕組みについてさらに詳しく調べるために、「ヘムを取り込んだ状態」、「ヘムを含まない状態」、「ヘムを含まずに遺伝子と結合している状態」のそれぞれについて、SPring-8を用いてX線結晶構造解析を実施。タンパク質を構成する1つひとつの原子の位置(立体構造)を決定した。
その結果、このセンサタンパク質がヘムを取り込む時には、アミノ酸の1種である「His72」と「His149」という2個の「ヒスチジン分子」(画像2)でヘムをつなぎ止めていることが判明。
そしてヘムを含まない時は、片方のHis72の近くにヒモ状に原子が並んだ構造があるが、ヘムが取り込まれるとその部分がラセン状の構造に変化することが確認された(画像2の橙色部分)。なお、この構造変化に伴って遺伝子と相互作用する領域が持ち上がり(画像1の緑色部分)、このタンパク質は遺伝子に結合できなくなる仕組みだ。
これらの結果は、遊離ヘムをセンサタンパク質が感知し、ヘム排出システムがスイッチオンとなる仕組みを、分子の構造変化という原子1つひとつのミクロなスケールで明らかにしたものといえる。
今回の研究では、乳酸菌のヘム排出システムを研究対象としたが、類似のシステムはある種の病原性細菌にも存在するという。研究グループは今回の成果によって、遊離ヘムによる細胞毒性を回避できなくすることで病原性細菌の増殖を阻害するという、新しいタイプの抗生物質の開発に貢献できる可能性があるとしている。
また、今回のX線結晶構造解析により、タンパク質を構成する原子の位置を詳細に明らかにできたことから、作用メカニズムを厳密に制御できる医薬品の開発が可能となり、副作用が少なく効果の高い薬剤の開発に貢献できるともコメントしている。