京都大学は、幹細胞の分化タイミングを制御する新しい分子機構を明らかにし、シグナルとエピゲノム制御の新しい連関と、それによる「細胞分化速度制御」という新しい概念を示したと発表した。
成果は、京大 再生医科学研究所の山下潤准教授らの研究グループによるもの。研究の詳細な内容は、6月14日付けで米専門誌「Cell Stem Cell」電子版に掲載された。
種々の幹細胞を用いた細胞分化研究が世界的な規模で盛んに行われているが、現在のところ細胞分化に要する時間は個々の細胞において内因性(intrinsic)に決定されており、分化のスピードを恣意的に制御することはできないものと考えられている。
培養条件などにより、細胞の分化「効率」が変化することは数々報告されているが、分化「速度」については、その"intrinsic"な決定を大きく変化し得るという報告は、これまでなされていない。
山下准教授らはこれまで、心血管系細胞の分化を系統的経時的に解析できる新しいES細胞分化システムを構築し、心血管細胞の分化再生研究を行ってきた。すなわち、マウスES細胞から「Flk1陽性」の「中胚葉」レベルの細胞を分化誘導し、そこから血管を分化させる新しい分化系を開発してきたのである。
また、Flk1陽性細胞からの心筋分化や動静脈リンパ管内皮分化、新しい内皮細胞および動静脈分化制御機構など種々の心血管分化機構も明らかにしてきた。さらに、マウスiPS細胞の心血管分化誘導にも2008年に成功しており、ES/iPS細胞の分化研究において世界的にも先端的である。
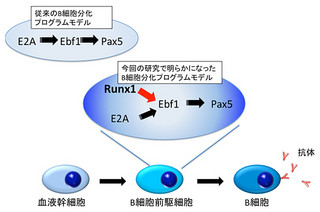
山下准教授らは、マウスES細胞の分化途上において、「Protein kinase A(PKA)」を活性化することにより、「中胚葉および血管内皮細胞の分化を従来の約2倍早く誘導する」ことを見出した。これらの結果は、制御不能と思われた分化速度が、恣意的に制御が可能であると共に、新しい分子機構により制御されていることを示唆するものだ。
山下准教授らは、PKA活性時に特定の「ヒストン修飾」が変化していることを突き止め、さらにこのヒストン修飾を誘導する分子「G9」aの機能阻害により「cAMP」の作用が消失する予備的結果を得ており、「外的シグナル→エピジェネティック制御→遺伝子発現→分化速度制御」に至る一連の新しい分子連関を明らかにできると考察したのである。
今回の研究は、山下准教授らが見出した新しい分化速度制御機構を明らかにし、細胞分化時間を恣意的に制御可能とすることを目的として行われた。
具体的には、(1)分化速度制御機構におけるPKAおよびG9aの意義の検討、(2)cAMPによるG9a制御機構の解明、(3)G9aによるヒストン修飾の標的遺伝子の同定、(4)これら標的遺伝子による分化速度制御機構の解明、の4点についての研究を行い、分化速度制御の分子的実体をエピジェネティクスを含む新しい分子連関として明らかにするというものだ。
1つ目の「分化速度制御機構におけるPKAおよびG9aの意義の検討」については、テトラサイクリン誘導性恒常活性型PKA発現ES細胞を用いて、PKAを活性化することにより、(i)中胚葉細胞および内皮細胞の出現が従来の約2倍早くなること、(ii)「H3K9me2」のヒストン修飾が特異的に亢進すること、の2点を見出している。
「タモキシフェン誘導性」に「Cre-loxPシステム」を用いてG9aをノックアウトできるES細胞システムが構築された。G9aのloss-of-function実験を含め、分化速度制御におけるPKAおよびG9aの機能的意義を確認している。
2つ目の「PKAによるG9a発現制御機構の解明」については、PKAによるG9a発現増加の分子機構を解析し、外的シグナル→エピジェネティック制御の連関を明らかにするということを目的に行われた。
3つ目の「G9aによるヒストン修飾の標的遺伝子の同定」については、未分化ES細胞マーカー「Oct4のH3K9me2」およびDNAメチル化に関与していることが報告されている。Oct4を含め種々の遺伝子のヒストンメチル化およびDNAメチル化につき検討するという研究内容だ。
4つ目の「これら標的遺伝子による分化速度制御機構の解明」は、G9aの標的分子群のそれぞれの分子機能を基に分化速度制御の分子機構を明らかにしていくというものである。外的シグナル(cAMP)→エピジェネティック制御→遺伝子発現→細胞のふるまい(分化速度)に至る新しい分子連関過程を明らかにするというわけだ。
そして、以下の4つの成果が上げられた。
1つ目は、G9aのノックアウトによって、PKAによる分化速度亢進が認められなくなることより、PKAによる分化速度亢進にG9aが必須であることが明らかとなったこと。
2つ目は、ユビキチンーリガーゼ「APC/C-cdh1」がG9aを標的としてG9aタンパクを分解することが2012年に報告されたことに関連する。APC/C-cdh1がES細胞分化においてもG9a分解に働いており、同酵素作用がPKAにより阻害されることが見出された。すなわち、PKA活性化はAPC/C-cdh1の不活化を介してG9aタンパクの分解を抑制するのが判明した。
3つ目は、G9aはOct4および「Nanog」のプロモータ領域に「H3K9me2」およびDNAメチル化修飾を加えることにより、これら未分化遺伝子の発現を早期に抑制し、それにより分化が早まると考えられたことだ。
4つ目は、G9aノックアウトマウスでは、Oct4の発現が遅延し、早期分化が遅れていることが明らかとなった。
これらの結果より、PKAはG9aの発現亢進効果を介して、未分化遺伝子の抑制的エピゲノム修飾を介して、ES細胞早期分化調節に働いていることが明らかとなり、これによりシグナルとエピゲノム制御の新しい連関と、それによる細胞分化速度制御という新しい概念が示されたこととなった。