東京医科歯科大学 大学院医歯学総合研究科の高柳広 教授と林幹人 研究員らの研究グループは、Semaphorin 3A(セマフォリン スリー エー:Sema3A)と呼ばれるたんぱく質が骨の健康を守り、このたんぱく質をマウスに投与すると骨が増加することを発見した。同成果は大阪大学 大学院医学系研究科、札幌医科大学 医学部附属フロンティア医学研究所、東京大学 先端科学技術研究センターなどの研究グループとの共同研究によって得られたもので、英国科学誌「Nature」オンライン速報版で公開された。
超高齢社会へと進む日本において、骨粗しょう症患者は推計1300万人を超え、その予備軍を含めると2000万人を超すとも言われている。骨粗しょう症は骨質と骨密度の低下により骨の強度が低下し、骨折しやすくなる状態を引き起こす。その結果引き起こされる大腿骨頸部や椎骨の骨折は、寝たきり状態や慢性腰痛の原因となり、QOL(生活の質)を低下させ死亡率を高めることが知られている。また、関節リウマチも罹患率の高い関節疾患であり(日本では70~80万人と推計されている)、進行してしまうと骨・関節の破壊により患者の運動機能が著しく損なわれてしまうことから、こうした疾患に対する治療法の開発が喫緊の課題となっている。
現在、骨の形成を促進させる薬剤はほとんどなく、骨粗しょう症治療薬としては、ビスフォスフォネート製剤など骨吸収を抑えることで骨の減少を防ぐ薬剤が主に使用されるようになってきたが、生体内では吸収した骨と同量の骨を新たに形成するという共役機構(カップリング機構)があることから、骨の吸収を阻害すると形成も同時に阻害されてしまうという課題があった。実際に、骨吸収抑制作用のある薬剤を長期間使用すると、結果的に適切な骨形成までもが抑制され、質の低い骨が蓄積されることで、十分な治療効果が得られないケースが知られている。また、骨形成を促進することで骨を増やす薬剤として、最近、副甲状腺ホルモン製剤が使用され始めたが、長期的な治療効果については統一した見解は得られていない段階だ。
一方、これまでの骨研究においては、骨吸収を抑制しつつ、同時に骨形成を促進することが可能な分子は見つかっておらず、そのため、健康な骨が恒常性を維持するメカニズムを詳細に解明し、骨吸収と骨形成とを同調して制御する生体内の分子を明らかにすることで、新しい薬剤の標的を見出し、効果的な骨疾患の治療薬を開発することが求められていた。
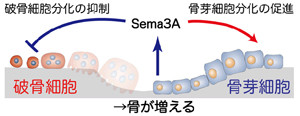
今回、研究グループは、マウスの骨芽細胞から分泌され、破骨細胞の分化を抑制する活性を持つ因子を探索し、プロテオーム解析を活用することで、骨芽細胞から産生されるSema3Aと呼ばれるたんぱく質が強力な破骨細胞の分化抑制活性を持つことを見出した。Sema3Aはこれまで、発生段階において神経細胞が軸索を伸ばし回路を作る過程に関わることや、免疫細胞であるT細胞の活性化を抑制すること、樹状細胞がリンパ節へ移動する過程に関わることなどで知られていたたんぱく質だ。
解析を進めた結果、Sema3Aは破骨細胞および骨芽細胞双方の分化に重要な役割を持つことが明らかとなった。
すなわち、Sema3Aは
- 破骨細胞および骨芽細胞上に発現するたんぱく質(受容体)「Neuropilin-1(ニューロピリン ワン:Nrp1)」を介して「Plexin-A(プレキシン エー)」に作用し、破骨細胞分化を抑制するとともに骨芽細胞分化を促進すること
- 破骨細胞分化に関わるシグナルの1つ「ITAM(アイタム)」シグナルを抑制すること
- 破骨細胞の運動能に関わる「RhoA(ロー エー)」シグナルを抑制し、破骨細胞が骨芽細胞に近づこうとする動きを妨げ、骨芽細胞と接することで誘導される破骨細胞の分化を抑制すること
の3つを明らかにしたのである。
また、骨芽細胞内では、Sema3Aは骨芽細胞の分化に重要な働きをする古典的Wnt/β-カテニンシグナル伝達系を介して骨芽細胞の分化を誘導し、骨芽細胞と由来を同じくする脂肪細胞への分化は相対的に抑制されていることも明らかにされた。
これらの結果から、骨芽細胞はSema3Aを産生することによって骨吸収の抑制と骨形成の促進の双方を制御し、適切な骨量を維持していることが導き出された。
Sema3AやNrp1遺伝子を破壊したマウスを調べたところ、破骨細胞の数と骨吸収が増えている一方、骨芽細胞の数と骨形成率が異常に低下しており、それに伴って骨髄中の脂肪細胞の数が増え、骨量も著しく減少していることが分かりました。これは、Sema3Aの働きが失われたことで破骨細胞の分化抑制が行われず、さらに骨芽細胞の分化が促進されないためだと考えられるという。
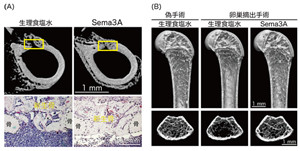
さらに、Sema3Aを正常なマウスに静脈注射によって投与すると顕著な骨量増加が認められたほか、骨にドリルで穴を開けてその部位の骨の再生を観察するモデルにおいても、Sema3Aを局所投与することで、より早い骨の再生を誘導できることが分かった。加えて、卵巣を摘出する手術を行って骨粗しょう症を発症させたマウスにSema3Aを投与すると、骨吸収抑制と骨形成促進がなされ、骨量の減少を食い止めることができることが確認された。これらの解析結果から、Sema3Aは、骨吸収と骨形成の共役(カップリング機構)を生じることなく、破骨細胞分化を抑制すると同時に骨芽細胞分化を促進することが分かり、カップリング機構の影響を受けにくい新たな治療薬のターゲットとなりうることが証明された。
さらに、老化して骨量が低下傾向にあるマウスでは、老化の進行に伴い血中のSema3Aたんぱく質量が低下していることも観察でき、骨減少疾病の診断バイオマーカーとしても利用できる可能性も示されたという。
今回の成果を活用することで、Sema3AをはじめとしたSema3A-Nrp1経路を活性化する治療法が、骨粗しょう症などの骨関連疾患に対して強い治療効果を発揮することが期待できるようになるという。実際に研究グループでは、マウスだけでなくヒトの細胞でもSema3Aが同様の作用を発揮することも確認している。また、これまでの報告から、Sema3Aは破骨細胞・骨芽細胞だけでなく、免疫系の細胞にも作用し、免疫抑制活性を持つことが知られており、関節リウマチのような免疫系と骨の両方に異常が生じる疾患の治療に対しても効果がある可能性も考えられるという。