理化学研究所(理研)と岡山大学は9月20日、免疫細胞の一種である「樹状細胞」が、抗原破壊の役割を持つ「キラーT細胞」へ抗原を提示するためには、ほかのタンパク質の介添え役のタンパク質「分子シャペロン」の「Hsp90」が必須であること、そしてその仕組みを分子レベルで明らかにしたとして発表した(画像1)。理研免疫・アレルギー科学総合研究センター免疫シャペロン研究チームのチームリーダー兼岡山大学大学院医歯薬学総合研究科免疫学教授の鵜殿平一郎氏を中心とする共同研究チームの研究によるもので、今回の成果は米科学アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America: PNAS」の9月19日の週にオンライン掲載される予定だ。
|
|
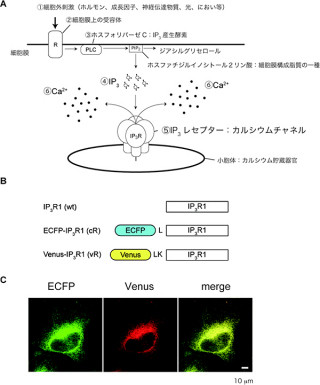
画像1。樹状細胞にあるHsp90が抗原提示の過程で果たす役割。キラーT細胞が活性化するには、まず樹状細胞が抗原を貪食するところから始まる。エンドソームに取り込んだ後、Hsp90により細胞質内に引き出され、抗原はそこでプロテアソームによりペプチドに分解される。そして、樹状細胞表面に移動して抗原が提示され、キラーT細胞が認識するという仕組みである |
ウイルス感染細胞やがん細胞などは、ウイルス抗原やがん抗原を細胞表面に持っているのだが、宿主にとって異物となる細胞を認識して破壊する役割を持つ免疫細胞の一種であるキラーT細胞を活性化することはできない。自分が取り込んだ抗原をほかの免疫系細胞に伝える役割を持つ「抗原提示細胞」の一種である樹状細胞が提示した抗原を認識しないと、活性化できない仕組みなのである。
抗原がどのようにキラーT細胞に認識されるのかというと、まず樹状細胞が貪食(どんしょく)し細胞内で酵素「プロテアソーム」により短いタンパク質の断片(ペプチド)に分解される。樹状細胞はそれを表面に運んで提示し、キラーT細胞がそれを認識して活性化するという仕組みだ。
この一連の過程において、抗原は樹状細胞内にある脂質二重膜で覆われた小胞「エンドソーム」内にあるのだが、一方でプロテアソームは細胞質にあり、両者が出会うためには抗原がエンドソームの膜をすり抜け、細胞質へと引き出されることが必要なのだが、そのメカニズムの詳細が40年近く未解明だったのである。
研究チームは2010年になって、樹状細胞が抗原提示を行ってキラーT細胞を活性化させるには、「熱ショックタンパク質」や「ストレスタンパク質」として、これまで熱やストレスに対する役割について研究されてきたタンパク質のHsp90が必要なことを試験管の実験では究明していた。しかし、それが個体レベルでも普遍化できるのかどうか、またその分子メカニズムがどうなっているのかといったことはまったくの不明で、それらを解明すべく今回の新たな実験が行われたという次第である。
Hsp90は、エネルギー減として利用されている「ATP」と結合する部位を持つ。ATPがつくと、抗原などのタンパク質を捕らえるようになる。Hsp90の阻害剤「ラデイシコール」はこのATP結合部位にはまり込む仕組みで、Hsp90の機能を消失させる特徴がある。
研究チームは、マウスから取りだした骨髄由来の樹状細胞に抗原を取り込ませて抗原提示させ、この抗原に特異的なキラーT細胞を活性化できる実験系を組み立てることに成功し、実験においてラデイシコールを樹状細胞に加えると抗原提示が止まることを発見した。
阻害剤の特異性の問題もあるため、続いては、アミノ酸配列がよく似たHsp90タンパク質ファミリーの1つである「Hsp90α」のノックアウトマウスを作製。その樹状細胞の機能を野生型マウスと比較する実験を行った。
まず、野生型マウスおよびHsp90αノックアウトマウスの骨髄から樹状細胞を樹立。一方で、抗原モデルとしてよく用いられる「卵白アルブミン」を取り込ませた脾臓細胞に紫外線を照射し、アポトーシス(管理・調節された細胞死)を起こした細胞を準備した。そして、次に樹状細胞にこの紫外線照射卵白アルブミン含有細胞を貪食させ、さらに貪食の完了した樹状細胞と卵白アルブミンに特異的なキラーT細胞を一緒に培養したのである。
キラーT細胞がOVAを抗原として認識すれば、炎症反応を引き起こす情報伝達物質「IFNγ」(インターフェロンガンマ)を産生するはずで、結果、Hsp90αノックアウトマウスの樹状細胞では、キラーT細胞が産生するIFNγ量は低下していることが判明した。要するに、樹状細胞にあるHsp90αが抗原提示に重要な役割を担っていることを示したのである。
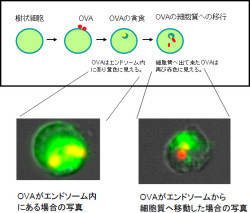
続いて行われたのが、樹状細胞が取り込んだ卵白アルブミンは、細胞内をどのように移動するのかの観察だ。卵白アルブミンを試薬「AF647」で赤色蛍光を発するようにし(AF647-OVA)、一方で細胞膜は「PKH67」でラベルして緑色蛍光を発するようにした。これにより、エンドソームの脂質二重膜も結果的に緑色蛍光を発するようになるというわけである。AF647-OVAは、樹状細胞のエンドソーム内に入ると、赤色蛍光と緑色蛍光が重なり、黄色蛍光を発するというわけだ。そしてAF647-OVAがエンドソームから細胞質へ引き出されると、緑色蛍光との重なりがなくなるので、今度は赤色蛍光を発するようになるのである(画像2)。
|
|
画像2。樹状細胞が取り込んだモデル抗原卵白アルブミンが細胞質へ移行する様子。赤色蛍光でラベルした卵白アルブミンを樹状細胞が貪食すると、緑色蛍光でラベルしたエンドソーム内に取り込まれ、黄色蛍光となる。卵白アルブミンが細胞質へ出てくると、赤色蛍光がとなる |
1万個以上の細胞のイメージ像として瞬時かつ定量的に解析できる最新の分析機器「ImageStream」を用いて定量した結果、Hsp90αノックアウトマウスの樹状細胞では細胞質へ移行したAF647-OVAの比率が少なく、またラデイシコールを入れた樹状細胞でも少なくなることが判明した(画像3)。これにより、Hsp90αが卵白アルブミンの細胞質移行へ必須であることを示す。また、より解像度の高い蛍光顕微鏡でも同様の結果が確認された。

|
|
画像3。エンドソームから細胞質へ移動したAF647-OVAの比率。野生型マウスと比べ、Hsp90αノックアウトマウスでは細胞質へ引き出された卵白アルブミンが減少している。また、Hsp90阻害剤のラデイシコールによっても、細胞質中の卵白アルブミンが減少した |
さらに、モデル抗原卵白アルブミンを貪食した樹状細胞を細胞質と細胞膜成分に分け、卵白アルブミンがどちらに局在するかを調査。貪食後5分経つと、卵白アルブミンは細胞質で検出され、レデイシコールを入れておくと細胞質へ出ずにエンドソームに留まることも判明した。
また、卵白アルブミンを貪食した樹状細胞からエンドソームを精製分離し、そこにHsp90だけを加えると、エンドソーム内の卵白アルブミンが外側に出てくることも確認。これが意味するのは、Hsp90だけで卵白アルブミンを細胞質へ非出すことができるということだ。
そして最後に行われたのが、個体レベルでの実験。野生マウスおよびHsp90αノックアウトマウスに「シトクロームc」を注射。シトクロームcは、特定の樹状細胞「CDB+ DC」に取り込まれて細胞質へ移行し、細胞にアポトーシスを引き起こしてCDB+ DCの数を減少させるという特徴を持つ。しかし、Hsp90αノックアウトマウスの樹状細胞では、この現象がまったく起きないという結果となった(画像4)。つまり、樹状細胞が取り込んだ抗原の細胞質移行が、個体レベルでもHsp90αに依存していることを示したのである。

|
|
画像4。マウス個体でのシトクロームcの効果。野生型マウスの場合、アポトーシスを誘導する敷くロームcを注射すると、脾臓内の樹状細胞(CDB+ DC)の数が減少するが、Hsp90αノックアウトマウスの場合、シトクロームcの影響がまったくない |
今回の研究により、樹状細胞が貪食した抗原は、Hsp90により細胞質へと引っ張り出されることが明らかになった。樹状細胞ががん・ウイルス抗原、さらには自己の生体成分である自己抗原の抗原を提示するにはHsp90が必須であることを示す結果だ。今後、Hsp90は生体防御の促進と自己免疫疾患の制御などに活用される新たな標的分子となることが期待されている。