東京農工大(農工大)は6月26日、人工的に創られた細胞モデルに骨格を持たせ、現実の細胞並みに硬くすることに成功したと発表した。
同成果は、東京農工大学大学院工学研究院先端物理工学部門 柳澤実穂テニュアトラック特任准教授、同大学院生の黒川知加子氏、東京工業大学情報理工学院情報工学系 瀧ノ上正浩准教授、慶應義塾大学理工学部生命情報学科 藤原慶専任講師、東北大学大学院工学研究科ロボティクス専攻 村田智教授らの研究グループによるもので、6月26日付けの米国科学誌「Proceedings of the National Academy of Sciences of the United States of America」オンライン版に掲載された。
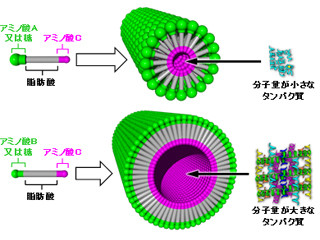
リポソームは、主に脂質からなる人工的な脂質二重膜小胞で、脂質二重膜を基本構造とする細胞膜のモデル研究や、薬用カプセル・化粧品などさまざまな分野で応用されている。しかし、膜が壊れやすく、内包物が漏れやすいという課題があった。壊れにくくし、さらにその強度を自在に変化できれば、カプセルとしての機能を大幅に向上することができる。
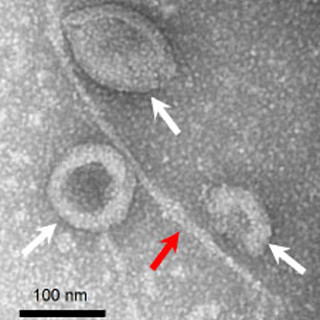
そこで今回、同研究グループは、リポソームの強度を上げるため、細胞骨格のように膜を支えるネットワーク構造をDNAナノテクノロジーにより構築した。今回の研究で用いたDNAは、温度低下に伴い、分岐を維持しながら互いに結合してネットワーク状の構造を作る。またDNAはマイナスの電荷を帯びているため、リポソームのなかのみにプラスの電荷を帯びさせることで、プラスとマイナスの引き合いにより膜直下へDNAの骨格を形成させることに成功した。
リポソームは通常わずかな浸透圧差で崩壊するが、同手法により、体内で想定される浸透圧変化環境においても崩壊しない強度となることが確認されている。強度はDNAの塩基配列により決定されるため、DNA構造を設計することによる強度制御が期待されるという。