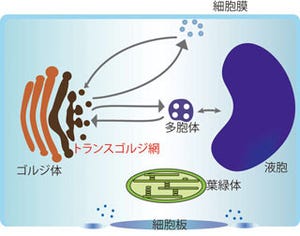
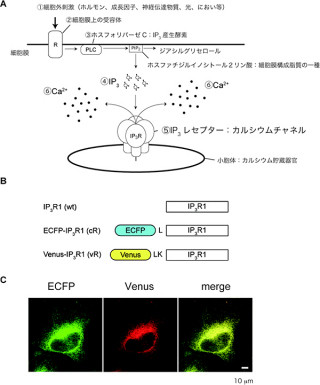
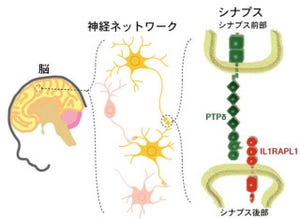
東京大学は1月23日、光が当たると陽イオンを細胞内に取り込む緑藻由来の膜タンパク質「チャネルロドプシン」の詳細な立体構造を解明。同構造と電気生理学的な解析を行った結果、チャネルロドプシンの初期反応を明らかにし、長らく論争になってきたチャネルロドプシンのイオン輸送経路を解明することに成功したと発表した。東京大学大学院理学系研究科の濡木理教授らの研究グループによるもので、成果は英科学誌「Nature」電子版に日本時間1月23日に掲載された。
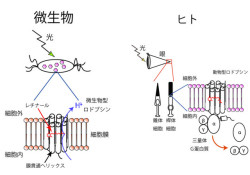
ヒトから微生物までほとんどの生物は光情報を受容して、光情報をもとに行動を取ることが知られているが、多くの場合この光情報の受容は、発色団として「レチナール」と呼ばれる低分子を結合した「ロドプシンファミリータンパク質」によって担われている(画像1)。
レチナールはビタミンAの一種で、光を受けると異性化することでシグナルを伝える仕組みを持ち、ヒトが物を見るのに使っている物質だ。またロドプシンファミリータンパク質は巨大なスーパーファミリーを形成する膜タンパク質で、補因子としてレチナールを結合した「7回膜貫通タンパク質」として、一次構造の違いにより、「微生物型ロドプシン」、「動物型ロドプシン」に分類される。
ロドプシンは微生物型・動物型を併せて考えると、複数の機能を持つ。「三量体Gタンパク質」(GαおよびGβγサブユニットからなる複合体タンパク質で、細胞内でシグナル伝達の重要な担い手として知られている)の活性化、水素イオンの「ポンプ」(ATPなどのエネルギーを使って基質となるイオンを能動的に輸送する膜タンパク質)、塩化物イオンのポンプなどである。
その中でも、チャネルロドプシンは緑藻類から発見された初めての、そして現在まで唯一の「光駆動型陽イオンチャネル」として注目を集めている。チャネルロドプシンは青色光が当たると陽イオンを細胞内に輸送するという機能を持っているが、その機能はほ乳類の神経細胞に発現させた状態でも保持されていることが2005年に発見されている。なおチャネルとは、基質となるイオンを受動的に輸送する膜タンパク質のことだ。
一般的に神経細胞はナトリウムイオンが細胞内に流れ込み、脱分極することによって興奮する仕組みだ。そのため、ナトリウムイオンを主な輸送基質とするこのチャネルロドプシンは、光照射によって好きな神経細胞を好きなタイミングで活性化させられる非常に有用なツールとして着目され、利用され続けてきたというわけである。
チャネルロドプシンが神経生物学分野に与えた影響は大きく、チャネルロドプシンを用いた神経回路の解析技術がNature publishing groupによって年1回選出される全生物学分野においてその年最も影響力を与えた実験技術の「Method of the year」で2010年に選ばれていることからもそれがうかがえる。
このようにチャネルロドプシンは多くの神経学者によって注目を浴び、使用され続けている一方で、光が当たるとどのようにしてイオンが運ばれるのか、そもそもイオンはこのタンパク質のどこを通っていくのか、といった基本的なメカニズムについての知見はほとんど得られていなかった。
その原因としてはチャネルロドプシンのような真核生物由来の膜タンパク質は一般的に不安定で大量に調製することが困難であったことが挙げられる。そこで、今回研究グループは現在までに報告されているチャネルロドプシン同士のキメラ体を多数作製することで、チャネルロドプシンを安定かつ大量に精製する方法を確立し、脂質中に膜タンパク質を再構成して結晶化する「脂質キュービック法」(3次元的に連続する状態層の脂質に膜タンパク質を再構成してから結晶化を行う手法)を用いることでチャネルロドプシンの結晶を調製することに成功した。
続いて、大型放射光施設「SPring-8」と、スイスの同様の施設「Swiss Light Source」を利用したX線結晶構造解析(タンパク質などの生体高分子の立体構造を明らかにする手段の1つであり、タンパク質結晶にX線を当てることで原子レベルの構造を決定することが可能)によって、チャネルロドプシンの閉じた状態の構造を高分解能で決定することに成功したという次第だ。
さらに、得られた立体構造から予測されるチャネルロドプシンの機能部位を改変し、電気生理学的解析を行うことで、チャネルロドプシンの光反応サイクルの初期反応やイオン透過経路を明らかにし、チャネルロドプシンを神経生物学のツールとしてさらに使い易くするための構造情報を提起することに成功したのである。
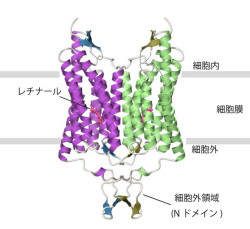
チャネルロドプシンの結晶構造から、チャネルロドプシンは従来の微生物型ロドプシンと同様に7本の「膜貫通ヘリックス」(画像1)から形成されている一方で、アミノ末端側に大きな細胞外領域「Nドメイン」を持っていることが判明。チャネルロドプシンはこのNドメイン同士の相互作用によって、微生物型ロドプシンとしては初めて二量体構造を形成していることが判明した(画像2)。
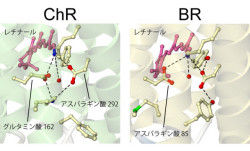
また、チャネルロドプシンをほかの微生物型ロドプシン「バクテリオロドプシン」と比較した場合、光サイクルの初期反応で非常に重要な働きをしている「アミノ酸残基」が、予想に反してバクテリオロドプシンとチャネルロドプシンでは異なっていることが示唆された(画像3)。研究グループはこの予想を「パッチクランプ法」(細胞膜を隔てたイオンなどの透過を電気信号として検出する手法の1つ)による電気生理学的解析によって、裏付けることに成功したのである。この結果はチャネルロドプシンの光サイクルを理解する上で、重要な1ステップになると考えられる次第だ。
加えて、チャネルロドプシンの1、2番目の膜貫通ヘリックスはバクテリオロドプシンと比較して大きく外側に傾いており、この傾きによってチャネルロドプシンの1、2、3、7番目の膜貫通ヘリックスの間には大きな空間が空いていることがわかった。
この空間は強い負電荷を帯びていたため、正電荷を帯びている陽イオンを透過する輸送経路として働いている可能性が高いと考え(画像4)、電気生理学的解析によってこれを検証した結果、この領域が実際に陽イオン透過経路として働いている可能性を強く支持する結果を得ることに成功したのである。
これは、チャネルロドプシンのイオン輸送経路が二量体の境界面を通るか、単量体の中を通るかという長い論争において、後者の立場を強く支持するものであり、チャネルロドプシンのメカニズムに対する理解を大きく一歩深めることができたと考えられようになった具合だ。
また、今回得られたチャネルロドプシンの閉状態の構造からはイオン輸送経路の中心にセリン残基、アスパラギン残基、グルタミン酸残基によって形成されるゲートの存在が明らかになった。
イオン輸送経路の解明とともに、ゲートの存在を明らかにできたことは、今後チャネルロドプシンの輸送メカニズムを完全に理解する上で大きな助けになると考えられている(画像5)。
今回の研究は、光駆動性陽イオンチャネルであるチャネルロドプシンの立体構造を明らかにし、その光サイクルにおける初期反応、イオン輸送経路、ゲートを解明することに成功したもので、今後、この成果によりチャネルロドプシンの構造機能解析の研究が進展することとなるほか、今回得られた構造情報を基盤としてチャネルロドプシンの性質が改良され、神経生物学のツールとしてより有用な変異型チャネルロドプシンが創出されることが期待されるという。また、これらの変異型チャネルロドプシンは、今まで解析が困難であった神経回路や神経疾患の解析に大きな力を発揮するため、基礎科学だけでなく医療分野への応用も期待されるとも研究グループではコメントしている。