東京大学(東大)は9月20日、抗がん剤や抗ウィルス剤などとして開発が進められている人工的に設計されたタンパク質「抗体ミメティクス治療薬」と、近赤外線の照射で活性化されることでがん細胞などを殺すシリコン・フタロシアニン化合物の一種である「Ax-SiPc」を結合させた、効果の高い光免疫製剤「FL2」の開発に成功したことを発表した。
同成果は、東大大学院 工学系研究科 先端学際工学専攻の金子雄大大学院生、東大大学院 医学系研究科の加藤洋人准教授、東大 アイソトープ総合センターの杉山暁助教、東大大学院 薬学系研究科の山次健三助教、東大の児玉龍彦名誉教授(東大 先端科学技術研究センター がん・代謝プロジェクトリーダー(特任研究員)、東大ベンチャーのサヴィッド・セラピューティックスの塚越雅信代表取締役社長らの共同研究チームによるもの。詳細は、日本癌学会の公式欧文学術誌「Cancer Science」に掲載された。
現在のがんの主な治療方法である手術療法(外科的切除や内視鏡的切除など)、化学療法、放射線治療は、がん細胞のみでなく、周囲の正常組織や臓器にも傷害を与えてしまうため、副作用として患者に大きな負担を強いることが分かっていることから、それを避けることを目的に、正常細胞や組織、臓器などを傷つけることなく、がん細胞のみにダメージを与える治療法の開発が求められている。
近年、この理論に基づいた新しいがん治療法として、近赤外光を使用した光免疫治療法の開発が進められており、切除の難しい、進行がんの患者のQOLを保ちながら実施できる治療として期待されている。
光免疫療法では、腫瘍細胞を認識する抗体として、光で活性化される化合物(光増感剤)を結合させた薬剤が使用される。そして薬剤の活性化には、腫瘍細胞局所に集まった光増感剤に効率よくエネルギーを与えるため、体の深部に到達できる波長690nmの近赤外光が使用される。光照射によりエネルギーを受け取った光増感剤は化学反応を起こし、細胞表面付近で細胞を傷害する物質(一重項酸素)を発生させることで、光増感剤が集積した腫瘍細胞のみを殺し、周囲の正常細胞、組織へのダメージをなくすというコンセプトだという。しかし近赤外線は人体内で届く範囲が限られており、治療後の再発が課題となっていたともする。
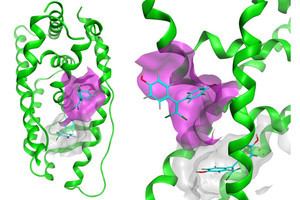
そこで研究チームは今回、人工的に合成された、製造しやすく腫瘍細胞表面に存在する抗原特異的に結合する抗体ミメティクス薬剤と、人工的に設計された、光を当てると一重項酸素を従来薬より多く作るAx-SiPcを結合させた治療薬を開発することにし、ヒト乳がん細胞に発現している「HER2分子」に特異的に結合するという特徴を持った治療薬の「FL2」の開発に成功したとする。