東京工業大学(東工大)は3月11日、二重鎖切断が起きたDNAで正確に修復されるように誘導するための分子機構を明らかにしたと発表した。
同成果は、東工大 科学技術創成研究院 細胞制御工学研究センターのアレクサンダー・ゾドラヴコヴィチ研究員、同・坪内英生助教、同・岩崎博史教授、米・テキサス大学ヘルスサイエンスセンターのパトリック・サン教授らの国際共同研究チームによるもの。詳細は、米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
DNA鎖が放射線などで損傷を受けた場合、破壊された遺伝情報を正確に復元するには、相同な配列を持つDNAを見つけ出しその領域をコピーする、いわゆる「相同組換え」を用いた修復が唯一の手段だ。
-
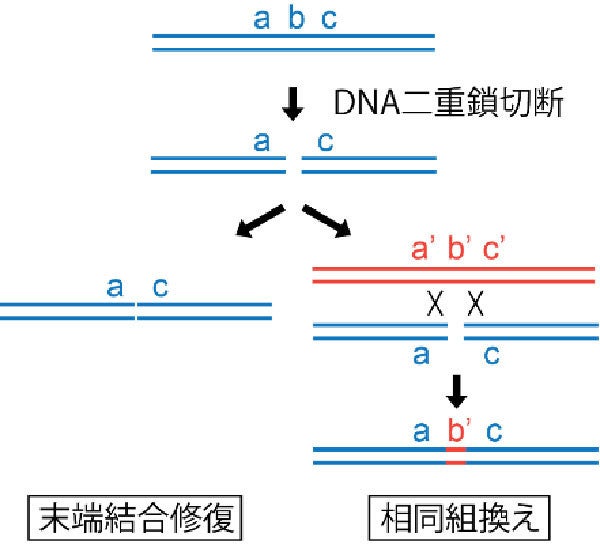
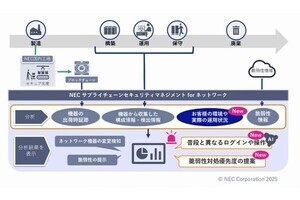
DNAで二重鎖切断が起きた場合の修復方法2種類。遺伝情報a、b、cを持つ領域に二重鎖切断が入り遺伝情報bが失われた場合、左の末端結合修復ではbが失われるが、右の相同組換えでは相同配列を元に修復するため、a、b、cとよく似たa'、b'、c'を参照した結果b'として復元される (出所:東工大Webサイト)
一方で、生物は切断されたDNAの二重鎖を取り敢えずつなげて修復する、いわゆる「末端結合修復機構」も併せ持っている。末端結合は二重鎖切断によるDNA損傷を手っ取り早く修復することができる一方で、まさに突貫の応急処置的な修復であるため、遺伝情報の喪失が不可避である。
二重鎖切断末端に対して「エキソヌクレアーゼ」の働きで一本鎖DNAが形成されると、その部分に対して相同組換えタンパク質である「RecA」ファミリーに属するタンパク質「RecAホモログ」が螺旋状に結合する。RecAホモログは結合した一本鎖DNAと相同な配列を持つ二本鎖DNAを探し出し、相同なDNA分子間でDNA鎖交換反応を行う活性を持つ。その結果、二重鎖切断の正確な修復が可能となる。どのようにして、このような機能が獲得されたのか、これもまた生命の神秘の1つだろう。
-
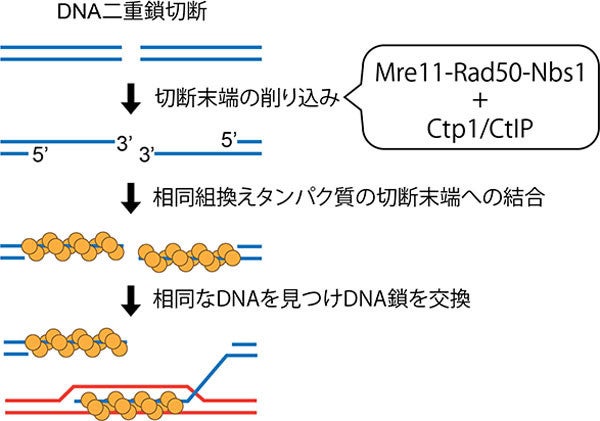
DNA二重鎖切断末端の削り込みが、相同組換えを誘導する。Mre11-Rad50-Nbs1は、Ctp1により活性化され二重鎖切断末端を削り込むため、二重鎖切断が相同組換えで修復されるようになるのである (出所:東工大Webサイト)
このように、二重鎖切断末端が削り込まれることで相同組換え修復経路への誘導が起こることから、その反応を担うエキソヌクレアーゼの活性化は相同組換えを誘導する際に決定的なスイッチの役割を果たすと考えられるとする。
そこで国際共同研究チームは今回、分裂酵母をモデルに、相同組換えの開始制御の分子機構について生化学的な解析を実施した。最初に、DNA二重鎖切断末端の削り込みに関与するDNAヌクレアーゼ複合体である「Mre11-Rad50-Nbs1」(MRN)と、その活性化因子である「Ctp1」が大腸菌で発現・精製された。
そして、二重鎖切断末端に対して起こる一本鎖形成反応を試験管内での再構成が試みられたのである。その結果、Ctp1がMRNを活性化する上で鍵となる2つの要因について、分子レベルでの特定がなされた。
まず、Ctp1はMRNと相互作用することでヌクレアーゼの活性化を行うが、その相互作用はCtp1のリン酸化に依存されており、Ctp1のリン酸化はMRNの中でも「Nbs1」との直接的相互作用を引き起こすことが確認された。
また、Ctp1のどの部位がMRNの活性化に必要かの探索が行われ、そのC末端が僅かにでも欠失するとMRNの活性化が起こらないことが判明。MRNの活性化に必要十分な領域を絞り込んだところ、Ctp1末端を構成するたった15アミノ酸からなるペプチドを反応系に十分量を加えるだけで、MRNの活性化が起こることが確認された。このことには、チームの研究者たちも驚いたという。
さらに、ヒト由来のMRNに、ヒトのCtp1ホモログであるCtIPのC末端由来のペプチドを加えることでも、MRNの活性化が起こることが見出された。このメカニズムが生物種間を超えて保存されていることが確認されたのである。
今回の研究により、MRNがCtp1により活性化される鍵となる要因が分子レベルで特定された。しかし一方で、Ctp1由来の小さなペプチドがどのようにMRNを活性化するのかは解明できておらず、今後の課題だという。国際研究チームは、ペプチドレベルの小分子が相同組換えを活性化しうることは興味深いとしている。
ヒトの場合、ゲノム編集は決して容易ではない。ヒトでは末端結合経路が主要な二重鎖切断修復系であることがその理由だ。しかし今回の研究成果から、細胞をペプチドで処理することで相同組換えを人為的に活性化させ、正確なゲノム編集を促進させられる可能性が見えてきたという。相同組換えの異常は、さまざまな遺伝性疾患の原因となることから、ペプチドで相同組換えを制御することが新たな疾患治療法の開拓につながる可能性もあるとしている。