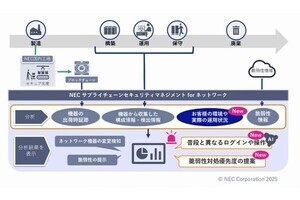
東京大学(東大)と東北大学は8月10日、生体内で情報伝達物質として機能する脂質分子「リゾホスファチジン酸(LPA)」の受容体であるLPA6の立体構造を解明したと発表した。
同成果は、東京大学大学院理学系研究科 濡木理教授、東北大学大学院薬学研究科 青木淳賢教授らの研究グループによるもので、8月9日付の英国科学誌「Nature」オンライン版に掲載された。
LPAは、負電荷を帯びた頭部と疎水的な炭化水素鎖により構成されており、細胞表面に存在するGタンパク質共役型受容体と呼ばれるタイプの膜受容体により認識されることが知られている。現在、6種のLPA受容体(LPA1~LPA6)が同定されており、LPA 分子はこれらの受容体を介して、細胞の増殖や細胞の移動などさまざまな細胞応答を引き起こす。
なかでもLPA6は毛髪形成に関わることが知られており、この経路が先天的に機能しない場合は先天性乏毛症と呼ばれる遺伝性疾患が引き起こされる。また、LPA6は血管を構成する内皮細胞にも発現しており、胎児期やがん組織における血管形成に関与することが示唆されている。このことから、薬剤開発の標的タンパク質として注目される一方で、LPA6がどのような仕組みでLPA分子を認識しているのかはわかっていなかった。
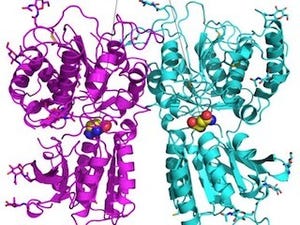
今回、同研究グループは、X線結晶構造解析の手法を用いて、ヒトLPA6と80%程度の配列類似性を持つゼブラフィッシュ由来LPA6の立体構造を、LPA分子が結合していない状態で決定した。LPA6の構造とLPA分子の化学構造から考えると、細長い溝にLPA分子の炭化水素鎖が、中央のポケットに負電荷を帯びた頭部が収容されるという、LPA6によるLPA分子認識のモデルが予想される。LPA分子のドッキングシミュレーションでも、この予想に合致するLPA分子の結合様式が確認されている。
従来、膜受容体は中央に形成されたポケットの中で情報伝達物質を認識すると考えられており 、これまでに報告された多数の膜受容体の立体構造からもその考えが支持されていたが、今回の研究で提唱された受容体側面の溝を用いてのLPA分子の炭化水素鎖の認識機構は、この従来の考え方からは予想できなかった完全に新規な仕組みであるという。
同研究グループは、今回の成果について、LPA6を標的とする薬剤候補化合物の探索と改変の試みが今後大きく進展していくものと説明している。