慶應義塾大学(慶大)は3月31日、がん幹細胞の詳細な機能の解析と、がん幹細胞を標的とした治療モデルの開発に成功したと発表した。
同成果は、慶應義塾大学医学部内科学(消化器) 佐藤俊朗准教授らの研究グループによるもので、3月30日付けの英国科学誌「Nature」に掲載された。
がん幹細胞は、がん組織に含まれる細胞のうち、自分自身の複製を無限に繰り返すとともに、分化細胞も生み出す能力を持つもの。ひとつのがん幹細胞から、がん組織を再構築できるため、がんの再発や転移などの能力が高いと考えられている。
幹細胞だけが発現する遺伝子としてLGR5が考えられており、分化細胞はKRT20という遺伝子を発現する。ヒトがん幹細胞の存在や機能検証が困難な大腸がんにおいても、正常な組織と同様にLGR5を頂点とするヒエラルキー構造を持ち、LGR5を発現するがん細胞とKRT20を発現するがん細胞から構成されていることがわかっている。しかし、がん幹細胞が存在するか、大腸がん組織内のすべてのがん細胞ががん幹細胞だけから産み出されるか、がん幹細胞を全て殺傷しさえすれば大腸がんを根絶することができるかは不明であった。
同研究グループは、これまでに、患者から採取した大腸がん細胞を効率的に培養するオルガノイド技術を開発していた。今回、このオルガノイド培養技術にゲノム編集技術を応用することで、LGR5の遺伝子領域に緑色蛍光タンパク質(GFP)を組み込んだ遺伝子改変オルガノイドを作製。LGR5発現がん細胞の子孫細胞を蛍光タンパク質で可視化したところ、ひとつのLGR5発現がん細胞が、自分自身を産生するとともに、分化した子孫細胞を増やしながらがん組織を増大させる様子を捉えることに成功した。これは、ヒト大腸がん組織内にがん幹細胞が存在することを裏付ける結果であるといえる。
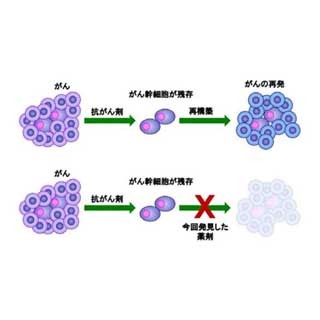
さらに同研究グループは、LGR5に自殺遺伝子を組み込む遺伝子改変を行い、特殊な薬剤によ りLGR5発現大腸がん幹細胞だけを殺傷する治療モデルを開発。このがん幹細胞標的治療は腫瘍の増大を止めることができたが、治療を中止すると再度増大。再増殖する腫瘍のなかには、殺傷したはずのLGR5発現がん幹細胞が再度出現しており、がん幹細胞を殺傷するだけでは根源的治療が難しいことが確認された。これは、完全にがん幹細胞を除去しても、分化がん細胞が次から次へと新しいがん幹細胞へ復活するためであるという。
がんオルガノイドを移植したマウスに、臨床で使用されているがん治療薬セツキシマブを投与したところ、がんは縮小するものの、根治には至らなかった。これは、セツキシマブ投与による治療ではがん幹細胞が残存し、治療の中止後にがんが再発するためと考えられるが、セツキシマブ投与の後にがん幹細胞標的治療を行うと、腫瘍の著しい縮小が確認された。これは、がん幹細胞を標的とした治療と、分化がん細胞を標的とするがん治療薬と組み合わせることにより、がんの根絶が可能である可能性を示したものであるといえる。
同研究グループは今回の成果について、臨床で使用できるがん幹細胞標的治療薬の開発や、分化がん細胞のがん幹細胞への脱分化を抑制して再発を予防する治療法の開発といった、新しいがんの根源的治療法の開発が期待されると説明している。