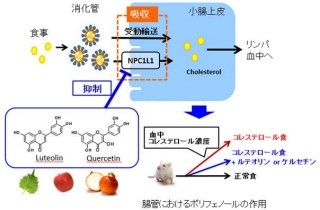
東京都医学総合研究所と東京都 福祉保健局は6月6日、脂質を分解する酵素ファミリーの生理的役割に関する研究を通じて、肥満の新しい調節機構として、脂肪細胞から分泌される2種の脂質分解酵素がそれぞれ肥満を改善または促進することを見出したと発表した。
同成果は、東京都医学総合研究所の村上誠 参事研究員、佐藤弘泰 研究員、武富芳隆 研究員、熊本大学の尾池雄一 教授、昭和大学の原俊太郎 教授、米国ワシントン大学のMichael Gelb教授らによるもの。詳細は、米国科学誌「Cell Metabolism」オンライン版に掲載された。
メタボリックシンドロームの病態基盤であるインスリン抵抗性は肥満に伴うことが多く、組織内に脂質が過剰に蓄積することが、脂肪毒性により細胞内ストレスや慢性炎症を引き起こし、インスリン抵抗性の要因となること、ならびに脂質代謝の異常は肥満、高脂血症、インスリン抵抗性の病態に密接に関与することまでは分かっているものの、その全体像はまだ良く分かっていなかった。
今回の研究では、高脂肪食を与えて肥満になったマウスと通常食で飼育したマウスの脂肪組織における遺伝子発現を比較し、肥満後に発現が誘導される脂質分解酵素の包括的な探索を実施。その結果、2種類の分泌性ホスホリパーゼA2(PLA2G5、PLA2G2E)が肥満マウスの脂肪細胞に発現誘導されることを見出したという。
この成果を受け、研究グループでは、この2種の脂質分解酵素の肥満における発現誘導の意義の解明を目指し、それぞれの遺伝子欠損マウスを用いて、メタボリックシンドロームの表現型解析を実施。具体的には、PLA2G5欠損マウスに高脂肪食を与えた場合、野生型マウス比で肥満が増悪し、またこれに伴って内臓脂肪蓄積、脂肪肝、高脂血症、インスリン抵抗性の増悪が確認され、内臓脂肪組織では炎症促進性のマクロファージ(M1タイプ)が増加する一方、炎症抑制性のマクロファージ(M2タイプ)が減少していることも確認されたという。
さらに詳細な炎症抑制機構の解明を行ったところ、脂肪細胞から分泌されたPLA2G5が血漿中の低密度リポタンパク質粒子に作用し、粒子を構成するある種のリン脂質から不飽和脂肪酸(オレイン酸、リノール酸など)を遊離することを確認。これら遊離された不飽和脂肪酸は、飽和脂肪酸によるM1マクロファージの誘導に対し、拮抗的に作用し、M2マクロファージへの形質変換を促進することも確認されたとのことで、これにより、PLA2G5が脂肪組織の慢性炎症を抑制する役割を果たしていることが示されたとする。
また、マウスと同様に、ヒトの内臓脂肪組織におけるPLA2G5の発現量と血漿低密度リポタンパク質の量にも有意な逆相関が認められたことから、酵素(PLA2G5)と基質(リポタンパク質)の関係はヒトにおいても成り立つことが確認されたと研究グループは説明する。
一方、もう1つのリン脂質代謝酵素「PLA2G2E」を欠損させたマウスに高脂肪食を与えたところ、PLA2G5欠損マウスの場合とは反対に、野生型マウスに比べて肥満、脂肪肝、高脂血症になりにくいことが示された。解析を進めた結果、PLA2G2Eはリポタンパク質中に存在するPLA2G5の標的リン脂質とは別の種類のリン脂質を選択的に分解していることが判明。これにより、脂肪組織から分泌されるPLA2G2Eは、リポタンパク質の微量リン脂質の量を調節することで、脂肪組織や肝臓への脂質の運搬・貯蔵を促進する役割を担う肥満誘導型酵素であることが示されたという。
今回の成果について研究グループでは、脂肪細胞から分泌され肥満を調節する分泌性ホスホリパーゼA2(メタボリックsPLA2)を同定した初めての研究成果であり、「メタボリックsPLA2」の作用は、従来の定説であった脂質メディエーターに依存した経路を介してではなく、リポタンパク質からオレイン酸などの不飽和脂肪酸を動員して脂質メディエーター非依存的に代謝性の慢性炎症を抑制する点にあることから、内臓脂肪組織における分泌性ホスホリパーゼA2の発現量やオレイン酸、リノール酸などの不飽和脂肪酸の量が、肥満の新規診断マーカーとなる可能性が示されたとするほか、分泌性ホスホリパーゼA2を標的とした創薬により、メタボリックシンドロームの新たな予防・治療法が開発される可能性も示されたとコメントしている。