九州大学(九大)は2月19日、「神経障害性疼痛」の慢性化に「二次リンパ組織」である脾臓における免疫細胞の1種「樹状細胞」のリソソーム酵素「カテプシンS」の働きによる抗原特異的なリンパ球の1種である「CD4+T細胞」の活性化が重要であることをマウスによる研究で明らかにし、活性化したCD4+T細胞は「脊髄後角」へ浸潤し、「インターフェロン-γ(IFN-γ)」を産生分泌することで「ミクログリア」の活性化をさらに深化させることが疼痛の慢性状態への移行に極めて重要であることを突き止めたと発表した。
成果は、九大大学院 歯学研究院の中西博教授らの研究チームによるもの。研究は科学技術振興機構 戦略的創造研究推進事業チーム型研究(CREST)の一環として行われ、詳細な内容は米国東部時間2月19日付けで米神経科学会誌「Journal of Neuroscience」に掲載された。
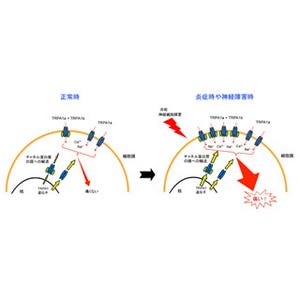
神経系における損傷または機能障害によって持続的な痛みが発生する神経障害性疼痛は、モルヒネも奏効しない難治性疼痛として知られている。近年、神経障害性疼痛の慢性化において、リンパ球の1種であるT細胞が関与することが示唆されていた。
しかし、その詳細なメカニズムについては不明な点が多く残っている。「単核食細胞」に特異的に発現するリソソーム性システインプロテアーゼの1種カテプシンSは「抗原提示細胞」の1種である樹状細胞において、抗原提示を行う「MHCクラスII分子」に結合している「インバリアント鎖」(MHCクラスII分子が抗原以外のペプチドとの結合するのを防ぐために結合したペプチド)の最終段階の分解に関与し、抗原提示機能の発現に重要な役割を担っている。
なお抗原提示細胞とは、抗原をT細胞に提示することで、T細胞を活性化させる役割を持つ。またMHCクラスII分子とは、抗原提示細胞の「エンドソーム」(細胞小器官の1種で、細胞内に存在する細胞外物質を取り込む小胞)内に存在するタンパク分子で、抗原を結合すると細胞膜表面に移行しCD4+T細胞に抗原を提示することで活性化させる働きを持つ。
中西教授らの研究チームは、これまでカテプシンS欠損あるいは脳移行性のないカテプシンS特異的阻害剤「Z-Phe-Leu-COCHO(Z-FL)」が、神経障害性疼痛の発症にはほとんど影響することなく慢性化を有意に抑制することを見出していた。
そこで研究チームは今回、カテプシンSが二次リンパ組織(リンパ球の抗原提示による活性化に関与する脾臓やリンパ節などの組織)での抗原提示によるT細胞の活性化に関与し、神経障害性疼痛の維持・慢性化において重要な役割を担っている可能性を検討することにしたのである。
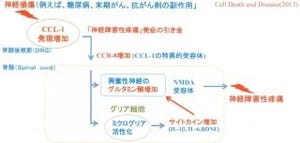
神経障害性疼痛モデルマウスは、脊髄神経を腰神経レベルで切断することで作成された。野性型マウス(DBA/2系統)では神経障害に伴い、二次リンパ組織である脾臓の肥大化が認められ、T細胞などが産生分泌するサイトカインの1種であるIFN-γを発現したCD4+T細胞(Th1細胞)の増大が確認された。また、脾臓に分布する樹状細胞においてカテプシンSが増大することも明らかとなったのである。
一方、カテプシンS欠損マウス(DBA/2系統)ではこれらの変化やインバリアント鎖の最終段階の分解は生じず、神経障害性疼痛の維持・慢性期における疼痛の有意な緩和が認められた(画像1)。また、野生型マウスにおける脾臓摘出によっても神経障害性疼痛の維持・慢性化が有意に抑制されることが確かめられたのである。
画像1のグラフでは、カテプシンS欠損マウスにおける神経障害性疼痛の有意な緩和が確認可能だ。グラフの見方は、PWT(g)は機械刺激に対する疼痛閾値で、「+/+」は野生型マウス、「CatS-/-」はカテプシンS欠損マウス。ipsiは神経障害側後肢への機械的刺激を表す。そして、contraは反対側後肢への機械的刺激だ。*p<0.05、**p<0.01、***p<0.001は野生型マウスの疼痛しきい値との比較である。
そこで次に神経障害性疼痛を発症した野性型マウスの脾臓よりCD4+T細胞を単離し、神経障害5日目のカテプシンS欠損マウスあるいは脾臓を摘出した野生型マウスに腹腔内投与が行われた。その結果、投与直後から3日間に渡ってこれらのマウスにおいて疼痛の有意な増強が認められたのである。
さらに免疫組織化学的解析の結果、IFN-γを発現したT細胞の神経障害側の脊髄後角(末梢知覚神経から送られてくる痛覚情報を上位中枢へ中継する脊髄の部位)への浸潤が確認された(画像2)。これは末梢神経障害に伴って「血液脊髄関門」(血液から脊髄への物質の移行を制限する機構)の透過性が一過性に増大するという報告と一致するという。
(画像2)
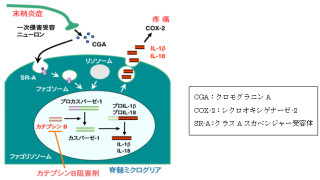
さらに、脊髄後角に浸潤したTh1細胞がIFN-γの産生分泌により脊髄ミクログリア(脳脊髄に存在し免疫機能を担う中枢神経中のグリア細胞の1種)を刺激し、ミクログリアの活性化をさらに深化させている可能性が検討された。IFN-γ受容体の下流シグナルである「STAT1」のリン酸化が調べられたところ、リン酸化STAT1はミクログリアの核に局在することが認められ、転写因子としての活性化が確認されたのである(画像3)。なおSTAT1とは、IFN-γ受容体の活性化によりリン酸化され、核内に移行して転写因子として働くタンパク分子のことだ。
以上の結果より、二次リンパ組織である脾臓における樹状細胞のカテプシンSの働きにより、抗原特異的に活性化したTh1細胞の脊髄後角への浸潤、ならびにIFN-γ を介した脊髄後角ミクログリアの活性化のさらなる深化が、疼痛の慢性状態への移行に極めて重要であることが明らかとなった(画像4)。
|
|
|
|
画像3(左):末梢神経損傷に伴うミクログリア核内におけるリン酸化STAT1の局在。Iba1はミクログリアの、GFAPはアストロサイトの、NeuNはニューロンのマーカー。pSTAT1はリン酸化STAT1を表す。画像4(右):カテプシンSの神経障害性疼痛の維持・慢性化における役割についての模式図 |
|
今回の成果により、神経障害により脾臓などの二次リンパ組織の樹状細胞におけるカテプシンSに依存したIFN-γ陽性CD4+T細胞(Th1細胞)の活性化が引き起こされ、活性化したTh1細胞の脊髄後角への浸潤によりIFN-γを介した脊髄後角ミクログリアの活性化状態のさらなる深化が引き起こされることが明らかになった。
このことからカテプシンSの二次リンパ組織での働きが神経障害に伴う疼痛の慢性状態への移行に極めて重要であることが示唆されるという。また今回の研究により、カテプシンSが神経障害性疼痛に対する治療薬開発における新たな標的分子となることが提示された形だ。一方で、神経障害に伴う二次リンパ組織における免疫応答にはマウス系統間での差異が認められ、C57BL/6系統マウスでは神経障害に伴うTh1細胞の活性化が認められていない。
このように末梢神経障害に伴って脾臓のような二次リンパ組織において分化した成熟T細胞は末梢血中に移出し、脊髄を含む体組織に浸潤すると考えられる。そこで今後は、神経障害性疼痛を発症した患者の末梢血におけるT細胞サブセットの詳細な解析を行うと共に、カテプシンS特異的阻害剤ならびに免疫抑制剤の神経障害性疼痛に対する治療薬としての有効性について検討を行う予定とした。