名古屋大学(名大)は2月5日、東京工業大学(東工大)との共同研究により、膜脂質「ホスファチジルイノシトール3リン酸(PI3P)」が「オートファジー(自食作用)」の際に形成される「オートファゴソーム」と呼ばれる膜の両面に非対称性に存在し、しかもほ乳類細胞と酵母細胞ではこれまでは共通と考えられていたが、両者でPI3Pの分布が大きく異なることを見出したと発表した。
成果は、名大大学院 医学系研究科・分子細胞学分野の藤本豊士 教授、東工大の大隅良典 特任教授らの共同研究チームによるもの。研究の詳細な内容は、2月2日付けで英オンライン科学誌「Nature Communications」に掲載された。
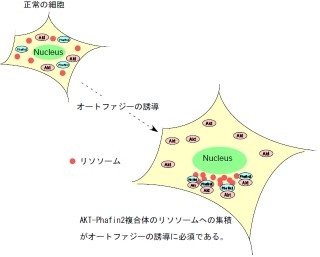
オートファジーは、細胞が不要な細胞質のタンパク質や「オルガネラ」を「リソソーム」に運んで分解し、新たなタンパク質の材料としてリサイクルする仕組みだ。オートファジーでは、細胞内に隔離膜という袋状の構造が出現し、細胞質の一部を取り囲み、それがオートファゴソームとなるのである(画像1)。
近年、オートファジーは細胞質成分の品質管理に必須のシステムとして注目され、この仕組みの破綻が神経変性疾患、がんなどの疾病に関連する可能性についても盛んに研究が進められている。オートファジーの分子機構の多くは「Atgタンパク質」などの解析によって理解が進んでいるが、オートファジー膜(隔離膜、オートファゴソーム膜など)がどのようにして形成されるのかは大きな謎として残されてきた。
オートファジーの成立には膜脂質であるPI3Pの産生が必須であることが知られていたため、PI3Pの細胞内局在を解析することにより、オートファジー膜形成の謎に迫れるのではないかと、研究チームは考察。従来の方法では膜脂質の詳細な観察ができないため、電子顕微鏡を用いる新たな方法を開発して、解析を実施したというわけだ。
まず研究チームは、PI3Pの細胞内局在をナノレベルで決定する新たな顕微鏡法として、細胞を急速凍結したあと、凍結割断レプリカを作製し、PI3Pに特異的に結合するプローブを結合させて電子顕微鏡観察を行うという技術「急速凍結・凍結割断レプリカ標識法」を開発。
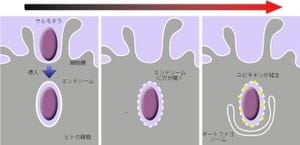
その新技術による観察の結果、オートファジーを誘導した酵母細胞では、PI3Pがオートファジー膜の閉鎖空間側(2枚のオートファゴソーム膜の間にある閉じた閉鎖空間に面した側)に非常に高密度に存在し、同じ膜の細胞質に面した側には僅かしか見られないことが見出された。それに対し、オートファジーを誘導したほ乳類細胞では、PI3Pはオートファジー膜の細胞質側に限局して存在し、閉鎖空間側には見られなかったのである(画像2)。
酵母細胞の細胞質にある2つの脱リン酸酵素(PI3Pを分解する活性を持つ酵素)を欠損させた酵母細胞ではオートファゴソームのPI3Pは細胞質側、閉鎖空間側に対称性に分布するようになり、野生型の酵母細胞で見られる非対称性は細胞質側PI3Pが分解されたことによって生じたものと考えられたという。よって、このPI3P分布の結果は、ほ乳類細胞と酵母細胞のオートファゴソーム膜形成過程に基本的な違いがあることを示唆するとしたのである。
PI3Pを産生する酵素「PI3キナーゼ」は酵母細胞、ほ乳類細胞ともに細胞質にだけ存在するという。ほ乳類細胞の結果はこのようなPI3キナーゼの作用で生じたものと理解できるが、PI3キナーゼが存在しないはずの閉鎖空間に面した側にPI3Pが存在するという酵母細胞の分布が生じるためには、何らかの別のメカニズムが必要なのはいうまでもない。今後、そのメカニズムを追究することにより、オートファジー膜が形成される機構の解明が進むと考えられるとしている。