慶応義塾大学(慶応大)は12月24日、心筋梗塞後に異常に活発になった好中球が、肺微小循環に捕らえられて停滞し、肺の血管内皮細胞を傷害する結果、血液内の液体成分が肺内にしみ出すために低酸素血症(呼吸困難)を引き起こすこと、また肺の中に存在するNK(ナチュラルキラー)細胞がその好中球による肺の血管内皮細胞傷害を抑制していることを発見したと発表した。
同成果は、同大医学部内科学教室(循環器)の佐野元昭 准教授と内科学教室(呼吸器)らによるもの。詳細は、米国心臓病学会誌「Circulation Research」オンライン版に掲載された。
心筋梗塞で閉塞した血管を再び開通させる「再灌流療法」の発達により、急性期の死亡率は低下したが、重症例の救命によって心筋の一部が壊死して組織を破壊し、心収縮力を低下させていく「梗塞後心筋リモデリング」による心不全の有病率が増加するという課題が生じるようになっている。
心筋梗塞後の組織修復の過程には免疫応答の活性化とこれに付随した炎症反応が発生することが知られており、近年の研究では、心不全の予防として、炎症を標的とした治療に注目が集まるようになってきた。
今回の研究では、リンパ球の一種で、腫瘍細胞やウイルス感染細胞を攻撃し除去する機能があり、がん治療にも応用されているNK細胞による治療法が、心不全治療として可能であるのかどうかを、マウス心筋梗塞モデルを用いて検証を行ったという。
具体的には、肺血管透過性に対するNK細胞の機能に着目して、研究を実施。NK細胞を除去したマウスは、除去しなかったマウスに比べると、心筋梗塞後に著しい呼吸不全に伴う低酸素血症を呈したものの、心筋梗塞後の心臓の左心室から全身へ血液を送り出す力は、NK細胞除去の有無では違いが確認できなかったという。
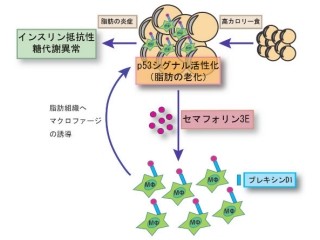
この結果、NK細胞を除去したマウスにおける呼吸不全に伴う低酸素血症の悪化は、心筋梗塞後の心臓の傷の治りが悪かったことが原因ではなく、好中球による肺の血管内皮細胞傷害の程度が重症化したことで、肺血管透過性が亢進したこと、つまり血液の液体成分がより多く肺の中へしみ出したことが原因であることが示唆された。
また、心筋梗塞後は24時間以内に、肺の血管内皮細胞が傷害され、好中球が肺胞隔壁、さらには肺胞内に浸潤することで、血管壁の通りがよくなってしまい、血液内の液体成分や赤血球も肺胞腔内にしみ出す結果、低酸素血症(呼吸困難)を引き起こすが、今回の研究では、肺の中の主たるIL-10産生細胞である肺NK細胞が、心筋梗塞後に肺の毛細血管の壁に近づき、IL-10を生み出すことにより、肺の毛細血管の壁に好中球が浸潤するのを抑制し、血液の液体成分が血管の外へしみ出すのを防ぐ役割を持つことも発見したという。
なお、これらの結果を受けて研究グループでは、NK細胞療法による心不全治療の可能性が拓かれたとコメントしている。