理化学研究所(理研)は11月12日、米・サンフォード・バーナム医学研究所などとの共同研究により、哺乳動物の細胞でタンパク質と糖鎖との結合(糖鎖修飾)に使われる「ドリコールオリゴ糖」において、低グルコース環境下で「ピロフォスファターゼ」によって未成熟型ドリコールオリゴ糖だけが分解されることを発見したと発表した。
成果は、理研 グローバル研究クラスタ 理研-マックスプランク連携研究センター 糖鎖代謝学研究チームの鈴木匡チームリーダー、同・原田陽一郎特別研究員、同・糖鎖認識研究チームの安形高志チームリーダー(現・台湾・中央研究院所属副研究員)同・疾患糖鎖研究チームの谷口直之グループディレクター、サンフォード・バーナム医学研究所のHudson H. Freeze教授らの研究チームによるもの。研究の詳細な内容は、11月11日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
糖鎖は、グルコース(ブドウ糖)などの単糖が複数個連なってできており、タンパク質や脂質などの生体分子に結合して性質を変化させたり、機能を付加したりして、生体分子の品質管理や細胞内輸送、細胞間コミュニケーションなどの重要な役割を担う。
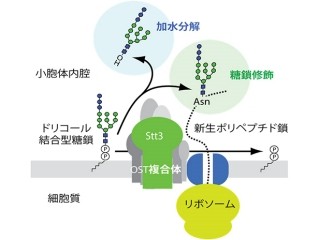
糖鎖が生体分子に結合することを「糖鎖修飾」と呼び、糖鎖と生体分子の修飾の組み合わせは多数存在する。中でもドリコールオリゴ糖は、糖鎖の種類の中でも最も一般的な「アスパラギン(N)結合型糖鎖修飾」の前駆体として用いられている物質だ。正確には、ドリコールオリゴ糖はN型糖鎖修飾の際、糖鎖の供与体基質となるのである。画像1にある通りに3つの構造ユニットから構成され、(1)糖鎖が(2)ピロリン酸を介して(3)ドリコールと呼ばれる「ポリプレノール」上に構築されている形だ。
また糖鎖修飾は、細胞小器官の1つである「小胞体」の内腔で行われる。糖鎖は、小胞体内腔の膜上にあるドリコール脂質上に単糖が複数積み重なって構築され、非成熟型から成熟型ドリコールオリゴ糖が合成されるのだ(画像1)。この際、単糖は、「GDP-マンノース」、「UDP-グルコース」、「UDP-N-アセチルグルコサミン」などの「糖ヌクレオチド」によってドリコール脂質へ運ばれる。複数の段階を経て合成された成熟型ドリコールオリゴ糖は、小胞体膜に存在する「オリゴ糖転移酵素」によってひとまとめに特定のタンパク質に結合する仕組みだ。
画像1が、小胞体におけるドリコールオリゴ糖の生合成経路を表した模式図だ。ドリコールオリゴ糖の生合成は小胞体膜上で起こる。まず、小胞体膜の細胞質表面で、「ドリコールピロリン酸」上に2つの「N-アセチルグルコサミン」と5つの「マンノース」が順次構築される。このドリコールオリゴ糖中間体が小胞体膜の内腔側へ転移されたあと、4つのマンノースと3つのグルコースがさらに付加され、成熟型ドリコールオリゴ糖が合成されるというわけだ。そして成熟型ドリコールオリゴ糖は、オリゴ糖転移酵素の触媒作用によってタンパク質の特定のアスパラギン残基(N)に転移されるのである。
これまでの研究から、ドリコールオリゴ糖の合成に関与する酵素の遺伝子に変異が起こると、「I型先天性糖鎖合成異常症(CDG-I)」が引き起こされることがわかっていた。CDG-I患者の線維芽細胞では、ドリコールオリゴ糖の成熟が滞るため成熟型ドリコールオリゴ糖が減少し、それによって多くのタンパク質において糖鎖修飾の効率が低下するため、全身性の重篤な症状が現れてしまう。近年、CDG-I患者の細胞において未成熟型ドリコールオリゴ糖が、ピロフォスファターゼによって分解され、リン酸化糖鎖へと代謝されることが明らかになってきたが、その生理機能はまったくわかっていない。
なおピロフォスファターゼとは、「ピロリン酸(P-P)」の間を加水分解する酵素の総称である。これまでに、ドリコールオリゴ糖のピロリン酸に作用するピロフォスファターゼの酵素活性の存在が報告されているが、このピロフォスファターゼをつくる遺伝子はまだ同定されていない。
一方、さまざまな哺乳動物由来の細胞において、細胞へのグルコースの供給量によってドリコールオリゴ糖の成熟度合いが変化することが知られていた。生命活動の維持に必要な十分量のグルコースがある環境では成熟型ドリコールオリゴ糖が合成され、速やかに糖鎖修飾に用いられる。しかし、グルコースが少ない環境(低グルコース環境)では、成熟型ドリコールオリゴ糖の合成が滞り、糖鎖修飾の効率が著しく低下することが知られていたが、この詳細なメカニズムは不明だった。
そこで研究チームは今回、低グルコース環境におけるドリコールオリゴ糖の合成のメカニズムを明らかにするため、生化学的な手法を用いて検証を実施。まず、マウス胎児由来の線維芽細胞を、生命活動の維持に必要な正常な量のグルコース環境と低グルコース環境に置いた時に合成されるドリコールオリゴ糖の定量が行われた。その結果、正常なグルコース環境では、予想通り成熟型ドリコールオリゴ糖が合成されるのに対し、低グルコース環境では成熟型ドリコールオリゴ糖の合成量が著しく減少することが確認されたのである。
次に、低グルコース環境で成熟型ドリコールオリゴ糖の合成量が減少するメカニズムを明らかにするため、過去の知見からピロフォスファターゼとの関係性が注目された。そこで、ピロフォスファターゼの分解によってできるリン酸化糖鎖の検出と定量を実施。その結果、低グルコース環境の時だけ、未成熟型ドリコールオリゴ糖の分解反応が起こり、リン酸化糖鎖が顕著に蓄積することが判明したのである。
続いて、低グルコース環境だけでピロフォスファターゼによる未成熟型ドリコールオリゴ糖の分解反応が起こるのか、そのメカニズムが検証された。ドリコールオリゴ糖の合成には糖ヌクレオチドによる単糖の供給が必須だ。これまでの研究から、グルコースの量によって糖ヌクレオチドの合成が制御されることが確かめられている。そこで、低グルコース環境における糖ヌクレオチドを定量した結果、糖ヌクレオチドの1つであるGDP-マンノースの量が劇的に減少していることが確認されたというわけだ。
さらに、未成熟型ドリコールオリゴ糖の分解反応が、グルコースではなく、GDP-マンノースの減少によって誘導されるかどうかの検証も行われた。通常、GDP-マンノースは、グルコースから主に合成されるが、マンノースからの合成経路もある。
そこで、グルコースからGDP-マンノースが合成される経路に必須な「MPI(マンノース6リン酸イソメラーゼ)」を欠失した細胞が用いられた。なおMPIとは、解糖系の中間代謝産物である「フルクトース6リン酸」と「マンノース6リン酸」の相互変換を触媒する酵素だ。マンノース6リン酸は、糖ヌクレオチドの1つであるGDP-マンノースの生合成に必須である。このため、MPIはグルコースを炭素源としたGDP-マンノースの生合成経路において不可欠というわけだ。このMPIを欠損した細胞の培地内のグルコース濃度を変化させずにマンノースだけを取り除くと、GDP-マンノースの合成経路を遮断することが可能だ。その結果、リン酸化糖鎖の蓄積が観察できたのである。
以上の結果から、低グルコース環境ではGDP-マンノースの合成が減り、それによって成熟型ドリコールオリゴ糖の構築が停止し、生じた未成熟型ドリコールオリゴ糖がピロフォスファターゼによって速やかに分解されることが判明したというわけだ。
それを図式化したのが画像2で、低グルコース環境下での糖ヌクレオチド、ドリコールオリゴ糖、リン酸化糖鎖の量的推移を表している。マウス胎児由来の線維芽細胞が低グルコース環境に晒されると、GDP-マンノースの合成量が減少。これに伴って、ドリコールオリゴ糖の成熟が滞り、成熟型ドリコールオリゴ糖が減少し、未成熟型ドリコールオリゴ糖が合成される。合成された未成熟型ドリコールオリゴ糖は、ピロフォスファターゼによって速やかに分解され、リン酸化糖鎖へと代謝されていくというわけだ。
今回の研究によって、ドリコールオリゴ糖の品質管理機構が存在し、未成熟型ドリコールオリゴ糖の異常な蓄積を防いでいることが示唆された。この機構は不完全な構造の糖鎖がタンパク質に結合することを防ぐのに必要と考えられるという。この反応に関わるフォスファターゼ遺伝子の異常はCDG-Iと同様の症状を引き起こすと考えられる。ピロフォスファターゼの遺伝子はまだ同定されていないが、将来この遺伝子が同定されれば、ドリコールオリゴ糖の品質管理機構の詳細が明らかにすることが期待できるとした。