慶應義塾大学(慶応大)は6月19日、切除が不可能な進行・再発大腸がん治療に頻用される分子標的治療薬の1種である「セツキシマブ」自体を「1次抗体」として用いて、大腸がん細胞の表面に位置する「上皮成長因子受容体(Epidermal Growth Factor Receptor:EGFR)」を検出する方法を新しく開発し、この新しい手法により測定した、大腸がんの細胞膜の表面にあるEGFR発現量と腫瘍の増殖を抑制する効果の相関を示すことに成功したと発表した。
成果は、同大医学部 外科学 一般・消化器外科教室の北川雄光 教授らの研究チームによるもの。研究の詳細な内容は、日本時間6月19日付けで米オンライン科学誌「PLoS ONE」に掲載された。
切除が不可能な進行・再発大腸がんの化学療法では、従来の「細胞毒性」(細胞に対して機能や増殖を障害して細胞死を誘導する性質のこと)を持った抗がん剤に加えて、細胞内シグナル伝達を制御する分子標的治療薬が、大腸がん患者の「生命予後」(生存する見込みのこと)の延長に重要な役割を担っている。なお分子標的治療薬とは、がん細胞が増殖するために必要なタンパク質を標的とした抗がん剤のことだ。
そしてセツキシマブは、大腸がん細胞の表面に位置するEGFRに結合し、EGFRからの細胞増殖・転移に関与するシグナル伝達を阻害して、がん細胞の機能を抑制する分子標的治療薬だ。このセツキシマブは、タンパク質遺伝子「KRAS」が変異した大腸がんに対しては、十分な治療効果が得られないことが臨床試験の結果から証明されている。
そのため、現在はKRAS遺伝子の変異の有無を調べることにより、セツキシマブによる治療効果がまったく見込めない患者への不必要な投与を回避することが可能だ。一方でKRAS遺伝子の変異がなく、セツキシマブにより治療効果が見込まれる場合でも、実際に治療効果が認められる患者は40-60%と報告されている。これを100%に近づけるためには、より高い治療効果が見込める患者を選別する、新たな「バイオマーカー」(薬剤治療において、投与する前に治療効果を予測することが可能な指標)が必要である考えられているという。
EGFRはセツキシマブの標的分子であるにも関わらず、これまでの研究から、EGFR発現量と治療効果に関連がないことが示されている。この矛盾の原因は、従来用いられているEGFRの測定方法では、セツキシマブが作用することのない余計なEGFRも同時に検出してしまうためであると研究チームは考察。
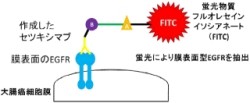
そこで、セツキシマブそれ自体を1次抗体として用いた「フローサイトメトリー法(FCM法)」により、大腸がんの細胞膜表面に存在するEGFR発現量を測定する新しい手法を開発し(画像)、蛍光物質である「フルオレセインイソシアネート(FITC)」を合成したセツキシマブ自身が結合することのできるEGFRのみを検出する方法を新しく開発。そしてセツキシマブが腫瘍の増殖を抑制する効果との相関を検討することに取り組んだのである。なおFCM法は、1つ1つの細胞にレーザー光線を照射し、蛍光の強さを測定するというものだ。蛍光物質により標識されたセツキシマブが多く結合するがん細胞では、より強い蛍光が測定される仕組みだ。
実験対象として、ヒト大腸がん由来の細胞株である「Caco-2」、「WiDR」、「SW480」、「HCT116」の4種を選定し、これらから「限界希釈法」(1個のがん細胞を分裂させ続け、単一の性質を持つクローンを得るための方法)によりEGFR発現量の異なる複数のサブクローンが作成された。そして新しいEGFR検出法を用いて、作成した各ヒト大腸がん由来の細胞株サブクローンのEGFR発現量を測定することにより、EGFR高発現および低発現を示す細胞株を抽出することに成功したのである。
この手法により得られたEGFR高発現または低発現を示す細胞株をシャーレ上で増殖させて、セツキシマブの治療効果を評価する実験も実施された。また、作成した細胞株を免疫不全マウスに移植し、この移植マウスにセツキシマブを投与することでの治療効果の検証も実施。その結果、どちらの実験系においてもEGFR高発現細胞株は低発現細胞株と比較して、明らかに強い腫瘍の増殖を抑制する効果が観察され、セツキシマブ自身により検出されたEGFR発現量がセツキシマブ感受性と有意に相関することが示されたというわけだ。
今後は臨床検体を用いた検証を重ねることで、KRAS遺伝子に変異のない大腸がん患者の中から特に高い治療効果が見込める症例の抽出が可能となり、薬剤選択に指針を与えることで、進行・再発大腸がん患者1人1人に最適な治療法の実現が期待されるとしている。