東京工業大学(東工大)は4月22日、細胞内の主要な分解システムの1つ、「オートファジー(細胞の自食作用)」に必須な因子の作用機構を分子・原子レベルで解明したと発表した。
成果は、東工大 フロンティア研究機構の中戸川万智子博士研究員、同・大隅良典特任教授らの研究チームによるもの。研究の詳細な内容は、4月1日発行の英国科学誌「Nature Structural & Molecular Biology」に掲載された。
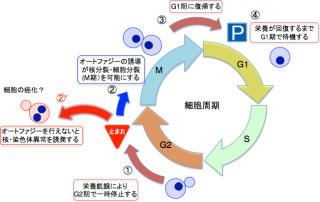
オートファジーとは、パンの酵母から高等動植物に至るまで、真核生物に広く保存されたタンパク質分解システムの1つだ。栄養欠乏状態になった時などにオートファジーは誘導される仕組みで、自分自身を一部分解することで、(1)栄養源として活用する、(2)貧環境下で生き残るために細胞の活性を下げる、(3)貧環境下に対応した性質に自らを再構築する、といった生理的な意義が想定されている。
また、異常なタンパク質や細胞小器官が生じた場合には、それらを選択的に分解・除去することで、細胞内の品質管理も行う。つまり、このオートファジーという機能があるからこそ、細胞は古くなったタンパク質や細胞小器官を溜めることなく除去して細胞の中身を新鮮に保つことができ、健全でいられるというわけだ。
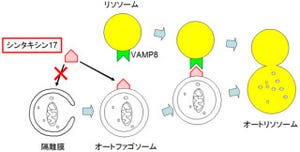
オートファジーは、分解の対象となるタンパク質を1つ1つ分解するのではなく、「オートファゴソーム」という脂質膜の袋で包み込んでひとまとめに分解する。つまり、オートファゴソームによる包み込みはオートファジーによる大規模な分解を達成するのに必須のステップというわけだ。
オートファジーが誘導されると、タンパク質や細胞小器官などを包み込んだオートファゴソームが形成される。オートファゴソームは、内部にさまざまな加水分解酵素を含み、分解を司る細胞小器官である「液胞」(高等動物では「リソソーム」)と融合し、中身が分解されるという流れだ(画像)。
オートファゴソームが形成されるには、ユビキチン様タンパク質「Atg8」が脂質分子と結合しなければならない。脂質と結合したAtg8が、オートファゴソームの材料となる脂質膜同士をつなぎあわせることで、膜の袋が形成されると考えられている。
なおユビキチン様タンパク質とは、76個のアミノ酸からなるタンパク質「ユビキチン」と立体構造が類似したタンパク質群の総称だ。ユビキチン様タンパク質が結合することでタンパク質の機能が制御されることが知られている。またユビキチンは、分解すべきタンパク質などの目印としてそれらに結合する仕組みを持つ。
Atg8と脂質との結合反応は酵素「Atg3」によって触媒される仕組みだ。また、この反応はオートファジーに必要なもう1つのユビキチン様タンパク質「Atg12」が「Atg5」と結合した「Atg12-Atg5結合体」によって促進される。しかし、Atg12-Atg5結合体がAtg3にどのように作用して、Atg8と脂質との結合反応を促進するのかはまったくわかっていなかった。
研究チームは今回、タンパク質の立体構造から得られる情報を基にして実験を実施。それにより、Atg12-Atg5結合体によるAtg3の活性化のメカニズムを明らかにした。Atg12-Atg5結合体が存在しない時にはAtg3の立体構造は不活性型となっており、Atg12-Atg5結合体がAtg3に作用するとAtg3の活性中心の立体構造が変化して活性型となることが発見されたというわけだ。この研究により、オートファジーにおける膜形成を駆動する重要な反応のメカニズムが分子・原子レベルで明らかになった。
また近年の研究で、オートファジーが十分に機能しないと、神経変性疾患や肝疾患、がん、糖尿病などの原因になることが示唆されているという。研究チームは、今回の研究で得られた情報を基にAtg3やAtg12-Atg5結合体をターゲットとした予防薬や治療薬の開発が期待されるとコメントしている。