東京大学(東大)は4月19日、神経入力の頻度と回数に依存して、神経細胞間の伝達効率が変化する「シナプス可塑性」が起こる過程を直接顕微鏡で動画として記録する新開発の「dFOMA(dual FRET with Optical MAnipulation)法」で観察し、シナプスの酵素が神経入力の情報を読み解く様子を、リアルタイムで観察することに成功すると同時に、これまで単に遺伝子の実態としてとらえられてきた酵素について、実はそれぞれ固有の情報処理を行う素子であるという新しい機能を明らかにしたと発表した。
成果は、東大 大学院医学系研究科 脳神経医学専攻 神経生化学分野の尾藤晴彦教授、同・藤井哉 特任助教らの研究チームによるもの。研究の詳細な内容は、4月18日付けで「Cell Reports」に掲載された。
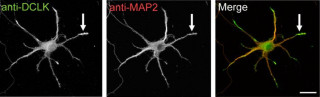
脳は神経回路が集合してできあがっており、その神経回路は神経細胞同士がつながってできている。そして、その神経細胞同士のつながりを介しているのが、シナプスだ(画像1)。そのシナプスを介したつながりは直接神経細胞同士がつながっているわけで1はなく、20nmのすき間があり、それは「シナプス間隙」と呼ばれる。
神経活動の信号の流れは通常は電気が担うが、シナプスの間隙においては、「グルタミン酸」などの神経伝達物質によって行われる。前シナプスの末端まで活動電位が到来すると神経伝達物質が放出されてシナプスの間隙を拡散し、神経入力として後シナプスの受容体によって受け取られること(これを神経入力という)で伝達される仕組みだ。
神経科学では、20世紀半ばから長らく、記憶がどのように作られるのかという問題に取り組み、シナプス可塑性によって学習が行われると考えられるようになってきた(画像2)。シナプス可塑性とは、神経入力の頻度と回数に依存して、神経伝達物質の放出確率や受容体の数が増減し、神経細胞間の伝達効率が変化することをいう。
そして、これまでは外界の情報は神経入力となってシナプスのさまざまな酵素を活性化して可塑性を引き起こし、記憶につながると考えられていた。画像2を例に取ると、この場合は例として長期的な受容体の増減による長期増強と長期抑圧を示している。また、このシナプス可塑性に伴ってシナプスの構造(大きさ)が変化することが知られている。
シナプスが入力の頻度に依存した可塑性を示す具体的な証拠が画像3だ。ラット海馬培養神経細胞のシナプスに、「ケイジドグルタミン酸の光融解」による刺激を100回、2種類の頻度(上段:5Hz、下段:20Hz)で行ったそれぞれの結果である。5Hzではシナプスの大きさに変化はなかったが、20Hzではシナプスが大きくなった(黄色の矢頭)。この構造変化は刺激したシナプス(黄色の点)のみで起こり、入力特異的にシナプス可塑性が誘導されたことを示している。
なお、ケイジドグルタミン酸とは、グルタミン酸に保護基が付加されたもので、通常では生理的な活性を持たないが、紫外光が当たることで保護基が脱離し、グルタミン酸となって活性を持つようになる物質だ。ケイジドグルタミン酸の光融解とは、その紫外光が当たることでグルタミン酸が生成することをいう。光を照射した部分だけでグルタミン酸が生成されるため、単一シナプスなど非常に限局した場所だけで神経細胞を刺激することが可能な技術だ。
|
|
|
|
画像2。シナプスの受容体は、入力の頻度・回数によって増減し、増えれば長期増強(伝達効率のアップ)、減れば長期抑圧(伝達効率のダウン)となる |
画像3。シナプスが入力の頻度に依存した可塑性を示す証拠。dFOMA法で撮影された |
また分子生物学では、人為的に遺伝子を欠損・変異させた動物を用いて、シナプス可塑性に関わる分子経路を同定してきた。特に、「CaMKIIα」と「カルシニューリン」というカルシウムイオン(Ca2+)によって活性化される酵素は学習と可塑性に関わる重要な酵素として知られている(画像4)。
しかし、この2つの領域をつなぐ知見、つまり、どのようにして神経入力の頻度と回数の情報を酵素が読み解くのか、またこれをシナプスがどのような演算ルールとして活用するのか、そしてそれらがシナプス可塑性という変化にどうつながるのかがわかっていなかった。
これはシナプスという、1μmの幅以下、容積にすると1fl以下の微小な部分に神経刺激を入れ、分離して化学分析することが技術的にできなかったためだ。このため、1980年代後半からさまざまな研究者によって試験管の中での再構成や、コンピュータシミュレーションといった代替手法によって研究が行われてきた。
しかし、こうした間接的・仮想的な知見が蓄積されるにつれ、まったく手付かずであった直接的な観察による分子メカニズムの理解が渇望されてきたのである。そこで研究グループは今回、シナプスにおいて酵素がどのように入力の情報を読み解いているのかを直接解明することを目標に研究を行った次第だ。
今回の研究によって、大別して2つの成果が上がったという。1つは、dFOMA法を用いて、人為的に神経入力の頻度と回数を変化させ、生きた神経細胞・シナプス内部のCaMKIIαとカルシニューリンの活性化の計測による結果だ(画像3、5)。その結果は、CaMKIIαは入力の頻度と回数の両方の情報を読み解き、カルシニューリンは回数の情報を読み解くことというものだったのである(画像6)。こうしてそれぞれの酵素が独自の非線形的な情報処理素子として働く結果、神経可塑性の周波数特性を産み出すことを実証したというわけだ。
画像5は、単一シナプスでのCaMKIIαとカルシニューリンの活性化のリアルタイム観察に関するものだが、もう少し詳しく説明しよう。上の列、青色の横長の囲みは海馬神経細胞のシナプスにおけるCaMKIIαの活性化を、そして下の列、ピンクの横長の囲みはカルシニューリンの活性化を表し、左の縦の列の黒い囲みは低頻度刺激(5Hz)で、右の縦の列の赤い囲みは高頻度刺激(20Hz)でそれぞれケイジドグルタミン酸の光融解刺激に対して計測した結果だ。それぞれの時刻(秒)における酵素活性化の空間的な広がりを色マップで示したもの。右の棒グラフは、5Hzおよび20Hzに対する酵素活性化の振幅を定量して示したものだ。
そして画像6は、CaMKIIαおよびカルシニューリンが担う情報処理機能を表したもの。Ca2+、CaMKIIα、カルシニューリンのそれぞれ囲みの中の2つの色マップは刺激の頻度と回数を変化させたときの活性化の振幅および積分を示している。この結果から、CaMKIIαの活性化は頻度および回数に依存し、入力の頻度・回数のデコーダーとして機能することがわかるという。一方でカルシニューリンの活性化は入力の頻度への依存性は低く、回数に大きく依存するため、入力回数のカウンターとして機能するというわけだ。
2つ目の成果は、生きたシナプスで複数の酵素活性を計測できる技術であるdFOMA法の開発に成功したことだという。dFOMA法は、近年開発されたさまざまな色の蛍光タンパク質、高感度のEM-CCDカメラといったさまざまな最先端技術をうまく融合させ、さらに顕微鏡の光学系の改良や200種類以上もの蛍光プローブを試行錯誤した結果、1fl以下のシナプス空間に限局した神経伝達物質投与(ケイジドグルタミン酸の光融解)と、2つの酵素の活性化をプローブの蛍光スペクトルの変化として観察する「2重化蛍光測定法」を組み合わせて誕生した技術である。
今回の結果は、記憶ができるときのシナプスでの酵素による情報処理機構という長らく多くの研究者が知りたがっていた問題に対して回答を与えることに成功したものとなる。また、これまで遺伝子の実態としてとらえられてきた酵素に、非線形的な情報処理素子としての機能があるという、新たな概念を生きた神経細胞で実証したものであり、シナプスでの現象をこれまでより一段と深いレベルで理解することに成功している。今回の結果は、記憶のメカニズムを理解する上で重要な知見となるという。
また最近では、CaMKIIαおよびカルシニューリンはアルツハイマー病や高次脳機能障害との関連も示唆されており、今回開発された方法や結果を応用することで、病理を解明につながることが期待されるとも、研究チームはコメント。
これまで生命現象は分子の経路としてとらえられてきたが、dFOMA法によってその経路の時間的・空間的なダイナミクスが理解できるようになったことは、例えるなら、単なる静的な路線図を見ていたところから、その路線上を走るさまざまな列車の運行や乗客の乗り降りが見られるようになるようなものだという。今後、dFOMA法を応用して生命現象をより深いレベルで理解することが期待されると、研究チームは語っている。