理化学研究所(理研)は4月2日、英ロンドン大学、米マイアミ大学との共同研究により、神経系に発現する膜タンパク質の1つをコードする「SLITRK6遺伝子」の変異が、近視と難聴の合併症の原因となることを発見したと発表した。
成果は、理研 脳科学総合研究センター 行動発達障害研究チームの有賀純チームリーダー、ロンドン大のアンドルー・クロスビー博士、マイアミ大のムスタファ・テキン博士らの共同研究グループによるもの。研究の詳細な内容は、日本時間4月2日付けで米科学雑誌「The Journal of Clinical Investigation」オンライン版に掲載された。
近視は、世界中で最も頻度の高い視覚障害の原因の1つで、特にアジアの都市部では発症頻度が70%を超えるという報告もあるほどだ。この内の重度の近視は約1~3%で見られ、網膜剥離、黄斑変性症、白内障、緑内障などを合併しやすいことが知られている。
外界からの光が網膜より前で焦点を結んでしまうことで起きてしまい、大別して眼球が奥行き方向に長いために起きる「軸性近視」と、角膜や水晶体の屈折率が強すぎるために起きる「屈折性近視」の2種類に分けられる。一般に近視と呼ばれるものは軸性近視のことをいう。
眼球は生後の成長過程で大きくなり、それに伴って視軸長も伸びる。視軸長が長すぎると「近視」、短すぎると「遠視」、適正範囲だと「正常視」となる(画像1)。これまでのサルを用いた研究により、出生直後に片目の光を遮ると、その眼が近視様の変化(視軸長の伸長)を示すことから(画像2)、網膜が受容する光情報が視軸長の調節に関わると考えられているが、具体的なメカニズムはわかっていなかった。
これまでのところ、近視の発症には遺伝子が大きく関与すると考えられており、多くの研究者が原因遺伝子の探索を行ってきた。しかし、患者共通の原因遺伝子がほとんど発見されなかったため、近視発症に数多くの遺伝子が複合的に関与していると推察されているところだ。
また近視と同様に発症頻度が高い難聴も、その発症には遺伝子の関与が大きいと考えられている。これまでの研究によれば、出生時の罹患率はおよそ0.1%で、9才までに倍加するという報告がある。また、ある遺伝子の変異が全身の系統的な異常を引き起こし、近視と先天性の難聴が合併して現れる症例もあるという。
例えば、結合組織をつくる「コラーゲン」の代謝に関連する一部の遺伝子に変異が起きると、軟骨の形成異常に伴って、骨や関節の形成異常と同時に近視と難聴が認められる。そうした事実を踏まえた上で、研究グループは今回、近視と難聴を合併して発症する家系を対象に、その原因遺伝子の探索解析を行った。
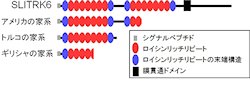
具体的には、クロスビー博士らは、米国の家系を対象に「ホモ接合体マッピング」(近親婚の家系の解析から、劣性遺伝疾患の原因遺伝子を染色体上で同定する手法)を用いて、またテキン博士らはトルコ人、ギリシャ人の家系を対象とした「エキソームシーケンシング」(全ゲノムの内、1%を占めるタンパク質コード領域の塩基配列を決定する手法)を用いて、網羅的に遺伝子変異の探索を行ったのである。
その結果、いずれも「SLITRK6タンパク質」をコードする遺伝子に変異があり、産生されるSLITRK6タンパク質には膜貫通ドメインが失われていることがわかった(画像3)。SLITRK6タンパク質は、視床や内耳などで産生されること、シナプス形成、神経突起の伸長制御に役割を持つことなどが知られている細胞膜貫通型タンパク質「SLITRKファミリー」の1つだ。SLITRK1~SLITRK6までの6種類があり、脳神経系に広く発現する。これらのタンパク質は神経突起の伸展制御とシナプス形成促進の機能を持つ。
そこで、理研の行動発達障害研究チームは、発見した変異SLITRK6遺伝子がコードする変異SLITRK6タンパク質の機能を解析。その結果、正常なSLITRK6タンパク質は細胞膜表面で検出されるが、3家系から得られた異なる3種類の変異SLITRK6タンパク質はいずれも細胞膜表面では検出されず、「シナプス形成を促進する能力」と「神経突起の伸展を制御する能力」を両方とも失っていることを突き止めたのである(画像4)。これらの結果から、SLITRK6タンパク質の機能喪失が近視や難聴を引き起こすのではないかと推測された。
|

|
|
近視と難聴合併症を発症する3家系で見出されたSLITRKタンパク質変異。画像3(左):変異SLITRK6タンパク質は膜貫通ドメインを失っている。画像4(右):正常なSLITRK6タンパク質は、培養細胞上でシナプス様の構造を誘導するが、見出された変異を持つSLITRK6タンパク質にはこの活性がなく、シナプスを誘導することができない |
|
なお、2009年に理研の有賀チームリーダーらの研究グループは、SLITRK6タンパク質を欠損するマウスが内耳の神経回路形成に異常をきたし、難聴を示すことを報告している。そこで今回は、SLITRK6タンパク質欠損マウスが近視の症状を示すか検討することにした。具体的には、欠損マウスの視軸長を測定するために造影剤を点眼し、MRI装置での解析を行った。
その結果、出生時の視軸長にはまったく差が認められなかったが、成熟時(10-12カ月齢)では正常マウスに比べSLITRK6タンパク質欠損マウスの視軸長が3.2%長くなっており(画像5)、視軸長の伸長異常は生後の成長過程で起きたことが判明。また生後の成長過程では、SLITRK6遺伝子が網膜で発現していることも明らかになった。
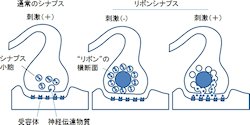
次に、SLITRK6タンパク質欠損マウスの詳細な網膜発達を検討するため、網膜を構成する各神経細胞のシナプスや神経突起を示すマーカー分布が調べられた。その結果、「リボンシナプス」と呼ばれる特殊な構造を持つシナプス(画像6)を示すマーカーの出現が、正常マウスに比べて遅れていた。この遅れは、マウスの眼が開き光刺激を受けて反応し始める生後10日前後に最も大きくなった。これらの結果から、SLITRK6タンパク質は、網膜内での神経回路形成を調節し、その機能が正常視の成り立ちに必要とわかった(画像7)。
なおシナプスとは、神経細胞間あるいは筋繊維や神経細胞と他種細胞間に形成され、シグナル伝達などの神経活動に関わる接合部位とその構造のことだ。そしてリボンシナプスとは、神経伝達物質を放出する部位にできるリボンと呼ばれる索状の構造を持つシナプスで、常時多数のシナプス小胞が係留されているため、強弱の差の大きな外界からの情報を恒常的に受け取ることができると考えられている。
画像7は、正常マウスとSLITRK6欠損マウスの網膜内での神経回路形成の比較をしたものだ。生後10日目のSLITRK6タンパク質欠損マウスの網膜では、双極細胞と視細胞の間にあるリボンシナプスのマーカーの集積が弱くなっており、シナプス形成が正常マウスにより遅れている。
リボンシナプスは、網膜のほかに内耳に存在することが知られている。今回の成果から、内耳の神経回路網の発達過程でも、SLITRK6タンパク質は似た役割を担っている可能性が示唆された形だ。
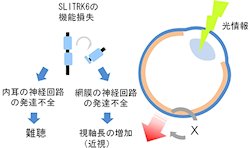
今後、理研の行動発達障害研究チームは、SLITRK6タンパク質欠損マウスの内耳のリボンシナプス形成の時期にも異常があるかどうかを検討する予定としている。特に、SLITRK6タンパク質がどのような分子を介して神経回路網の発達過程に関わるのか(画像8のX)、その謎の解明を目指すという。
なお画像8は、SLITRK6の神経回路網の発達過程との関係と今後の研究課題をまとめたものだ。SLITRK6の機能不全は、内耳および網膜の神経回路発達不全を引き起こす。網膜では生後発達過程で光情報が何らかの要因(X)を介して視軸長の調節に重要な役割を果たすと知られている。SLITRK6欠損マウスは、この過程に異常があるために視軸長の延長(近視)が起きると考えられる。
これらの点が解明されると、正常な視覚や聴覚の発達に対する理解が深まると同時に、近視や難聴の発症メカニズムのさらなる理解と新たな治療法開発に役立つことが期待できると、有賀チームリーダーらは述べている。