慶應義塾大学(慶応大)は1月23日、ヒトiPS細胞から皮膚の前駆細胞を作成し、毛を誘導する能力を持つマウスの「幼若線維芽細胞」と共に免疫不全マウスに移植することにより、毛包構造の再現に成功し、再生された毛包内にヒト細胞由来であることを示すシグナルが検出されたことから、ヒトiPS細胞が毛包構造の一部を再生したことを確認したと発表した。
成果は、同大 医学部皮膚科学教室の大山学専任講師、同・生理学教室の岡野栄之教授らの共同研究グループによるもの。研究の詳細な内容は、1月15日付けで専門誌「Journal of Investigative Dermatology」電子版に掲載された。
ヘアスタイルが個人の印象を大きく左右することがあることからもわかるように、脱毛症が患者に与える精神的ダメージ、社会生活への影響は大きなものがある。しかし、外傷、熱傷などによる脱毛、進行期の男性型脱毛症など毛包が不可逆的に傷害された脱毛症に対する治療法は非常に限られているのが現状だ。
例えば自家植毛はこうした症状に有効な治療だが、この方法は自分の毛包を使用するので移植できる毛包の数が限られてしまう。そのため、ヒト毛包を再生し脱毛部に移植する再生医療の開発が望まれている。
毛包はその構造の主体をなす皮膚の細胞「ケラチノサイト」と、毛包の下端(最も皮膚の深い部分)に位置し毛髪を作る、あるいは、毛包自体を再生させるシグナルをケラチノサイトに出す「毛乳頭」の細胞により構成される(画像1)。
画像1は、ヒト毛包の構造(断面組織標本)。毛包の本体はケラチノサイトが筒状の構造を形作っている(画像の青い部分)。下端に毛乳頭細胞(画像の赤い部分)があり、それに接する特殊なケラチノサイト(毛母細胞)にシグナルを送り分裂させ「毛幹」、いわゆる毛髪(画像の黒い部分)を作り出す。
これまで、マウスを使用した研究では分離したケラチノサイトと毛乳頭細胞を混合し、生体内に戻すと自然に毛包が再生されることが報告されていた。理論的にはヒトでも同様の操作で毛包の再生ができる可能性はあるが、実際に医療に応用する場合には大量の細胞が必要となる。
このような場合、通常、生体から採取した細胞を培養し細胞数を増やすが、ヒトのケラチノサイトや毛乳頭細胞は培養すると毛包を作り出す性質を失ってしまうという大きな問題があった。ただし、ヒトiPS細胞はさまざまな細胞になる能力と、高い増殖力があり、毛包を再生するのに必要な細胞を作り出すためには最適な素材といえる。
そこで研究グループは今回、ヒトiPS細胞からケラチノサイトになる手前のさまざまな細胞に分化できる余力を残した前駆細胞を誘導し、それを用いて毛包の再生を試みたというわけだ。
まず、異なるドナーから作成された3つの系統のヒトiPS細胞を、ケラチノサイトへの分化を促進する条件で培養し、ケラチノサイトになる手前の前駆細胞を作製。
次にヒト毛乳頭細胞と3系統のヒトiPS細胞に由来する前駆細胞を一緒に培養したところ、「201B7」というヒトiPS細胞株から得た前駆細胞が毛乳頭細胞と最も良好に相互作用することがわかった。
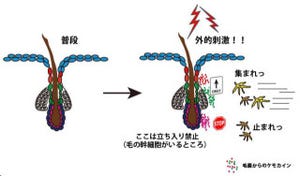
201B7iPS細胞株由来前駆細胞と毛を誘導する能力の高いマウスの幼若線維芽細胞を混合して免疫不全マウスの皮下に移植したところ(画像2)、2-3週間後に毛包の構造が再現された(画像3)。
再生されたハイブリッド毛包ではヒト由来の細胞であることを示すシグナルが検出され、ヒトiPS由来の細胞が毛包構造の一部となっていることが確認されたのである。
また、再生された毛包でヒトの毛包幹細胞に特徴的な遺伝子の発現が見られたことから、頻度は低いと考えられるが、ヒトiPS細胞に由来する細胞が毛包の元となる幹細胞となっている可能性があることがわかった。
前駆細胞に誘導していない、または、誘導の途中のiPS細胞とマウス幼若線維芽細胞を混合し免疫不全マウスの皮下に移植した場合には、毛包の構造は再現されるが、iPS細胞が直接毛包構造に組み込まれる所見がなかったことから、ヒトiPS細胞は毛包構造の再生に直接関わるだけでなく、さまざまな因子を放出することなどにより間接的にも毛包再生を促進していることが考えられた。
今回の実験の条件では、ヒトiPS細胞由来ではない通常のヒトケラチノサイトをiPS細胞由来前駆細胞の代わりに使用した場合には毛包構造は確認できず、ヒトiPS細胞を毛包再生に利用する利点を支持する結果となっている。その点に関して、研究グループは「興味深いこと」としている。
今回の研究により、ヒトiPS細胞を利用して毛包を再生できる可能性が示された形だ。脱毛症の病態の研究、再生医療の実現に向けての一助となると思われる。
また、毛包などの器官を形成するには、完全に分化した細胞より、分化途中の前駆細胞を用いた方が有利である可能性も示された。成人の組織の細胞を前駆細胞に戻すことは技術的に困難だが、iPS細胞から前駆細胞を誘導することは比較的容易であるため、iPS細胞を再生医療に使用する利点が別の角度からクローズアップされたことになる。
さらに、今回の研究によりiPS細胞は系統ごとに特性が微妙に異なり、目的ごとに(今回の研究の場合には毛包再生に適した)その特性を事前に評価することが大切であることが改めて明らかになった。
ただし、ヒト再生毛包の実用化の観点から見ると、まだ解決するべき課題が多く残っている。特に、今回の研究では毛包の本体はヒトiPS細胞から作ることに成功しているが、毛包を作るシグナルを出す細胞にはマウスの細胞が用いられた。これはドナーから採取できるヒトの毛乳頭細胞の数が限られることと、毛乳頭細胞は培養すると毛包を誘導する力を失うことによるものだ。
とはいえ、すでに研究グループは、培養で1度失われたヒト毛乳頭細胞の特性を回復させることに成功しているほか、ヒトiPS細胞から毛乳頭細胞を再生することも理論的には可能だとしている。今後は、マウスの細胞の代わりにこうしたヒトの細胞を使うことにより、完全にヒト細胞からなる再生毛包が作成可能になることが期待されると、研究グループはコメント。また、ヒト再生毛包は脱毛症治療に使用可能であるのみならず、毛包の発育を促進する薬剤の開発など多方面で活用される可能性があるともコメントしている。
さらに、これまで再生医療の手法により培養したケラチノサイトからなる皮膚のシートが作成され、実際に重症熱傷の治療に用いられてきたが、これには毛包や汗腺などの皮膚の付属器がなかった。すでにヒトiPS細胞から皮膚シートは作成可能であることから、今回の研究は付属器を有するより実物に近い再生皮膚実現への第1歩ともいえるという。
そして、あえて完全に分化しきっていない前駆細胞をヒトiPS細胞から作成し、器官形成に使用するという今回の研究コンセプトは、ほかの器官の再生にも応用できることから、今後の再生医療への応用が可能であると考えられるとも述べている。