理化学研究所(理研)と科学技術振興機構(JST)は1月4日、がん細胞を特異的に殺すT細胞からiPS細胞を作製すると共に、そのiPS細胞から同じがん抗原と反応するT細胞を大量に分化誘導することに成功したと共同で発表した。
成果は、理研 免疫・アレルギー科学総合研究センター 免疫発生研究チームの河本宏チームリーダー、同・免疫器官形成研究グループの古関明彦グループディレクター、同・ラウール ビスカルド特別研究員らの研究グループによるもの。研究の詳細な内容は、日本時間1月4日付けで米国科学誌「Cell Stem Cell」オンライン版に掲載された。
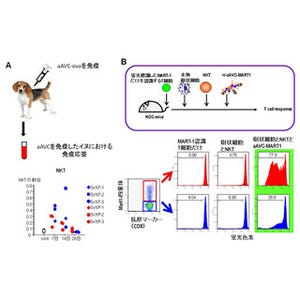
今回の研究では、がん抗原に反応するT細胞からiPS細胞を作製し、そのiPS細胞から元のがん抗原に反応できるT細胞を分化誘導することが目的とされた(画像1)。
成熟したT細胞の中で、抗原から刺激を受ける前の段階のT細胞を「ナイーブT細胞」と呼ぶが、これはいろいろな抗原に対して応答できる反応性を持った細胞の集団だ。
その中で、がん細胞に反応できるT細胞はがん抗原の刺激によって増殖し、働くことができる「エフェクターT細胞」になる。しかし、がん細胞にはエフェクターT細胞を抑制して無力化する性質があり、がん細胞に対する免疫反応が起こりにくくなっている(画像2)。
要するに、がん患者でもがん細胞を攻撃することができるエフェクターT細胞は生成するが、その多くは無力な状態になってしまっているというわけだ。
現行のがん免疫療法は、がん患者の体内にあるわずかな「働ける」エフェクターT細胞を患者の体内、あるいは生体外で成熟T細胞を刺激して、さらに働かせようとするものである。
ここで問題になるのは、刺激されて活性化されたエフェクターT細胞の寿命が短く、せいぜい1~2週間しか生きないとされている点だ(画像3)。このため、がんに対する免疫反応が持続せず、現行の免疫療法の最大の課題となっているのである。
これを解決するために研究グループが考えたのが、iPS細胞技術の利用だ。この戦略を理解するには、T細胞の反応の仕組みを理解する必要がある。
T細胞は、「T細胞レセプター」を用いて抗原を認識し反応する仕組みで(画像4)、T細胞レセプターにはさまざまな反応性を持つものがある。そしてT細胞レセプター遺伝子は、断片化した状態でゲノム中に存在している(画像5)。
T細胞は胸腺という組織で作られる過程の中で、いくつかの断片を組み合わせて遺伝子の切り貼りを行い、T細胞ごとに異なるレセプター遺伝子が作られるのだ。これは、「遺伝子再構成」と呼ばれる現象だ。従って、T細胞は細胞ごとに異なる構造のT細胞レセプターを発現していることになるのである。

|

|
|
画像4。T細胞レセプターは、抗原提示細胞の上に載せられた形で提示されている抗原提示分子に結合することにより、抗原を認識する |
画像5。細胞ごとに異なるレセプターを作るメカニズム。画像中のA、B、X、Y、Zは、細胞のゲノム上に存在するT細胞レセプター遺伝子の断片 |
そのようなT細胞の内の1つからiPS細胞を作ると、再構成された遺伝子の情報が受け継がれる(画像6)。当然、そのiPS細胞からT細胞を分化誘導すると、元のT細胞と同じ抗原と反応するT細胞ばかりになるというわけだ。この原理が実際に働くことは、マウスのNKT細胞からiPS細胞が作製された研究で確認済みである。
なお、体細胞から作製したiPS細胞を材料としてT細胞を作ると、多様な遺伝子再構成が起き、さまざまな反応性を持つT細胞群になってしまうため、その中のごく一部のT細胞しかがん細胞を攻撃できない(画像7上段)。
しかし、がん細胞を攻撃できるT細胞をあらかじめ取り出しておいて、そのT細胞からiPS細胞を作製し、そのiPS細胞を材料として「キラーT細胞」を分化誘導させると、すべてのT細胞に元のT細胞と同じ反応性を持たせることが可能だ(画像7下段)。つまり、生成したすべてのT細胞ががん細胞を攻撃できることになる。
こうした戦略により、がん細胞を攻撃できるT細胞を大量に作ることができれば、前述のようながんに反応できるT細胞の少なさや寿命の短さという問題を克服できるというのが、今回の研究のコンセプトだ。
研究グループが材料として用いた細胞は、「ヒト悪性黒色腫」というがんに特有の「MART-1」という抗原に反応できるキラーT細胞だ。これは、米国立衛生研究所(NIH)でヒト悪性黒色腫の患者から分離され、培養されていた「JKF6」と呼ばれる細胞で、T細胞マーカーである「CD3」という分子と、キラーT細胞マーカーである「CD8」という分子を発現している。
この細胞に、山中因子(Oct3/4、Klf4、Sox2、c-Myc)の遺伝子を導入し、またiPS細胞作製の効率化を図るために遺伝子「SV40」も用いて、iPS細胞が作製された(画像8)。そして、同iPS細胞はMART-1-iPS細胞と名付けられたのである。
なお、遺伝子導入にはセンダイウイルスが用いられた。センダイウイルスで導入された遺伝子は、ゲノムの中に挿入されないので、T細胞のゲノムを傷つけることはない。
MART-1-iPS細胞が十分な機能を持った質のよいiPS細胞であるかどうか、さまざまな方法によって検証された。例えばコロニーの形状、遺伝子発現のパターン、染色体異常の有無、さまざまな組織への分化能などだ。
その中で最も重要なポイントである「さまざまな組織への分化能」が調べられた結果を示したのが、画像9である。MART-1-iPS細胞を先天的に胸腺を欠く「ヌードマウス」の皮下に注入し、4週間後に生成した細胞を組織学的に解析。すると、外胚葉、中胚葉、内胚葉系のいろいろな組織へ分化していることが確かめられた。すなわち、iPS細胞とみなせる細胞であることが実証されたのである。
次にMART-1-iPS細胞からT細胞への分化誘導が行われた。方法は、2009年に報告された手順を基に、独自の改変が少し加えられている。iPS細胞をフィーダー細胞「OP9細胞」と共培養した後、培養13日目で別のフィーダー細胞「OP9/DLL1細胞」との共培養にスイッチ(画像10)。
その後も培養を継続すると、培養35日目にはCD8(キラーT細胞マーカー)とCD4というヘルパーT細胞の分化マーカーを共に発現する細胞が出現した。これは、成熟細胞の1歩手前の未成熟なT細胞に該当する。
この時点で、未成熟のT細胞が発現しているT細胞レセプターの性質が調べられた。T細胞レセプターがMART-1抗原に結合できるかどうかは、MART-1テトラマーという試薬を用いて染色することで調べる。結果は、生成したT細胞の多くがMART-1抗原と結合できるものだった。
フィーダー細胞との共培養では、未成熟T細胞の段階で分化が停止してしまう。この段階で、T細胞レセプターはすでに発現しているが、機能的には未成熟だ。しかし、それ以上に分化させる方法は知られていなかったのである。
そこで、独自に開発された方法によってさらなる分化誘導を試みられた。その方法は、T細胞が発現しているCD3に対する抗体を加えることにより、T細胞レセプターに刺激を与えるというものである(画像11)。この方法を用いた結果、抗体添加の6日後に、元のキラーT細胞と同じCD8を発現する細胞を大量に得ることに成功したというわけだ。
また、このCD8陽性細胞は、ほぼすべてがMART-1抗原を認識できるタイプ、すなわち元のキラーT細胞と同じ反応性を持つT細胞レセプターを発現していたのである。
このT細胞レセプターがMART-1抗原に結合できることはテトラマー染色で検証に成功したが、さらにMART-1抗原で刺激して活性化することができるかどうかもテストが行われた(画像12)。
生成したキラーT細胞と標的細胞(EBウイルスでがん化したB細胞)を混ぜて培養しただけではT細胞は活性化されないが、MART-1抗原を添加して24時間培養したところ、抗原の刺激を受けて「ガンマインターフェロン(IFNγ)」が産生されたのである。
IFNγはキラーT細胞がよく産生するサイトカインという情報伝達物質の1種で、抗腫瘍活性を持っている。この実験により、MART-1-iPS細胞から分化誘導されたT細胞がMART-1抗原に反応するT細胞であることが確認できた。
冒頭で述べたように、がん免疫療法については、現在もいろいろな試みがなされている。そのほとんどはすでに体の中にあるくたびれたエフェクターT細胞を何とか励まそうというもので、それは得られる細胞数や寿命には限りがあった。
研究グループの今回のアプローチは、体外で未成熟なT細胞から新たにエフェクターT細胞を作ろうというものであり、既存の方法とまったく異なっているのが特徴である。
実際、今回の研究で生成した成熟細胞は主にエフェクターT細胞に当たると考えられ、すなわち寿命自体は、それほど長くないと思われる。しかし、iPS細胞からの分化誘導を繰り返せば、大量の細胞を継続的に得ることが可能だ。従って、現行の方法が直面している壁の突破口になる可能性があるとした。
なお、今回の研究では、試験官内でエフェクターT細胞にまで分化誘導したが、こうしたエフェクターT細胞を作って生体に戻すということを、必ずしも最終的なゴールとしているわけではないという。
理想的なゴールとして想定しているのは、「胸腺で分化を始める直前、すなわち前駆細胞の段階まで生体外で分化誘導して、生体に戻す」ことだ。研究グループでは、注入された前駆細胞は、患者の胸腺に移住してT細胞に分化するはずだと考えているという。
こうすれば、本来の胸腺環境で分化が起こるので、体外で分化誘導した場合と違ってナイーブT細胞が大量に胸腺で作られるはずだ。そこへがん抗原を用いて適切に免疫することで、過去の抗原情報を記憶できるメモリT細胞を誘導することもでき、持続的な抗腫瘍免疫が期待できると考えているとした。
iPS細胞の臨床応用は、薬剤のスクリーニングや毒性試験などの応用も考えられているが、第一義的には欠損した組織の再生による補完だ。しかし、その対象となる疾患は、そう多くはない。
今回の研究により、リンパ球の特性を活かしたiPS細胞の応用によって、がんという疾患を対象とする可能性が出てきた。実用化できれば、iPS細胞技術の恩恵を受けることができる患者の数は、一気に数10倍に広がる可能性があるという。
今回の研究では、原則として免疫の拒絶反応が起きないように、患者本人すなわち自己のiPS細胞から分化誘導したT細胞を利用することが想定されている。特に、前駆細胞を胸腺に移住させて持続的な抗がん免疫を作りだすという方式では、自己細胞を使う必要があるというわけだ。
しかし、生体外で分化誘導したキラーT細胞を繰り返して患者に投与する場合は、T細胞から作製したiPS細胞のバンクを確立して、それらを利用することも可能である。
その場合、移植後に拒絶されないようにするためには、あらかじめいろいろな種類のT-iPS細胞を作製しておく必要がある。品質保証という点では、むしろT-iPS細胞バンクを用いる方が、実現性が高いと考えるとしている。