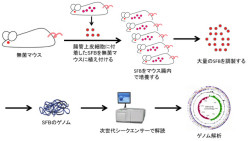
東京大学は9月15日、免疫細胞「Th17」の誘導活性を持つ腸内細菌の一種であるセグメント細菌「SFB」(Segmented filamentous bacteria)の全ゲノム構造を解明したと発表した。同大学大学院新領域創成科学研究科附属オーミクス情報センターの服部正平教授を中心とする研究グループによる研究で、成果は科学雑誌「Cell Host & Microbe」(9月15日号)に掲載される。
Th17細胞は、特に病原細菌やカビ類に対する感染防御に極めて重要な役割を果たしている、免疫系の「ヘルパーT細胞」の一種。しかし、その過剰応答が慢性関節リウマチやクローン病、潰瘍性大腸炎などの自己免疫疾患に深く関与しており、近年はその発症メカニズムの解明と治療が求められている。Th17細胞は通常は腸管にだけ存在し、2009年に腸管のSFBが特異的に誘導することが発見された。
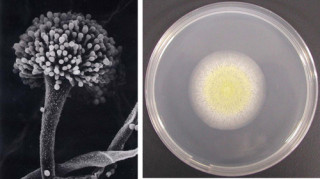
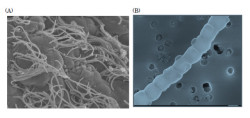
一方のSFBは昆虫や動物の腸上皮に強力に接着する特徴的な細菌だ。その腸上皮に協力に接着していることと、名称の由来にもなった複数の最近細胞が連結した長い糸状の独特の形態を取ることが特徴となっている(画像1)。しかし、SFBは試験管内で純粋に培養できない難培養性細菌のため、その正体は長く不明のままだったのである。
|
|
画像1。ラットSFB の走査電子顕微鏡写真。(A)は、腸管上皮細胞に刺さったように付着するSFB。(B)はヒトのSFB の拡大写真で、複数の細菌細胞がつながって糸状となっている。1つの細菌の長さは約1.7μmで、これが70個以上つながって全長が100μm 以上にもなったSFBも存在する(A:ヤクルト中央研究所梅崎好則博士撮影、B:麻布大学森田英利博士撮影) |
研究グループは、かつてSFBに関する研究を進展させた、ヤクルト本社中央研究所の梅崎良則博士らによって1990年代に開発されたSFBだけが腸内にいるマウスとラットを利用。今回の研究では、SFB-マウスとSFB-ラットから、高純度のSFBを大量に精製することに成功したのである。
そして、安価かつ高速な「次世代シーケンサ」を用いて、SFBの全ゲノム配列を高精度に決定し、「バイオインフォマティクス」(情報生物科学)により全遺伝子を同定したという次第だ。これにより、マウスおよびラットのSFBは約150万塩基対のゲノムを持ち、約1400個の遺伝子がそれぞれのゲノムにコードされていることが判明した(画像2)。
約150万塩基対というゲノムサイズは、これまでのところ報告されている腸内細菌の中では最も小さい。例えば、大腸菌ゲノムの3分の1程度になる。当然ながら遺伝子の数も少なく、生存に必要な遺伝子の多くが欠落しているということがわかった。このようにゲノムサイズが小さく、生存に必須な遺伝子を多数欠落しているという特徴は、昆虫の共生細菌に似ている。なお、欠落している遺伝子は、糖類を代謝してアミノ酸を作る遺伝子群などだ。
その一方で、SFBは自身で作れないアミノ酸を周囲の環境から取り込むための遺伝子を多数持っていることも判明。そのほか、宿主のタンパク質を分解する酵素も保持している。つまり、SFBは宿主に大きく依存して共存する細菌であることがわかったというわけだ。この性質は、感染症を引き起こす病原菌の生存戦略にも似ているが、SFBは病原菌が通常持っている感染症に直結する病原遺伝子は持っていないことは判明している。
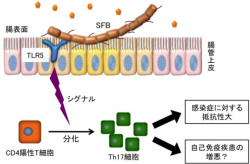
続いて、SFBの免疫誘導機能に関わる遺伝子を探索したところ、SFBが常在菌ではまれな自然免疫に関与する「べん毛遺伝子」を有していることがわかった。さらに、べん毛を構成する「フラジェリンタンパク質」が、昆虫や脊椎動物の細胞表面にある受容タンパク質で、さまざまな病原体を完治して自然免疫を作動させる「Toll様受容体5」(TLR5)に認識される「アミノ酸モチーフ」(TLR5モチーフ)を有することも確認された。TLR5モチーフを持つべん毛は複数の病原菌に見られるが、常在菌ではまれな例となっている。
TLR5による自然免疫の発動は、侵入してくる外来病原菌を駆逐する宿主側の防衛最前線における仕組みであり、最終的に炎症反応を引き起こす。よって、SFBが示すTh17細胞の分化誘導、消化管や呼吸における免疫機構の最前線である免疫グロブリンの一種「IgA抗体」の分泌促進や、「腸上皮細間リンパ球」の増加などの一連の免疫誘導活性は、このTLR5モチーフを持つべん毛が関与している可能性が強く示唆された(画像3)。しかし、SFBを持つマウスもラットも、さらにはほかの動物にも炎症が見られず、要するに健康であり、炎症に至らないSFBの作用メカニズムは未解明で、今後の研究の課題となる。
そのほか、SFBには90個以上の表層タンパク質が存在することも判明。これらの表層タンパク質がべん毛とともに、SFBの免疫誘導機能や腸管上皮細胞への強固な付着に関与することも示唆されている。
進化系統的にSFBは、腸内や土壌に生息している「クロストリジウム」というグラム陽性細菌群に近い関係がある。クロストリジウムは、破傷風菌やボツリヌス菌など、強力な病原菌を含む種類だ。今回の解析でも、SFBはクロストリジウムに最も近い菌種であることが確認されている。
クロストリジウムの特徴は「芽胞」を形成できる点だ。SFBも今回の解析で芽胞形成に必要な遺伝子を多数持っていることが判明。電子顕微鏡観察によって、糸状ではなく球場の単一細胞としてその芽胞が確認されている。要するに、SFBは生息できない環境中では芽胞として生きながらえ、子孫を宿主に伝搬する仕組みを有すると予想された。
ヒトSFBについては、その存在を示す報告が1990年代に1つあるだけで、ヒトSFBの存在は現在も不明のままだ。しかし、今回の研究の中で発見もあり、ヒトSFBの存在を示唆する「16SリボソームRNA遺伝子」(地球上のあらゆる細菌・原核生物が遺伝子に持つ、細胞内のタンパク質合成工場リボソームを構成する必須のRNA分子)をヒトの表皮細菌叢の中に確認している。ただし、ヒトの皮膚に付着したほかの動物のSFBに由来するという可能性もあり、得られたデータが本当にヒトSFBの存在を示す証拠であるという結論には至っていない。
また、SFBは宿主特異的に生息する。マウスのSFBはラットの腸では生息できず、その逆も同様だ。両SFBのゲノムの比較から、全遺伝子の90%以上が両SFB間で共有される一方で、それぞれのSFBに特異的な遺伝子も数十個発見されている。これらの特異的な遺伝子の中に、SFBの宿主特異性に関与する遺伝子が含まれている可能性が示唆された。
SFBの全ゲノムが解明されたことにより、そのゲノム情報を足がかりに試験管での培養に一歩近づいたといえる。また、SFBの諸機能を遺伝子レベルで調べられるようになったことから、Th17細胞の誘導を初めとした腸内細菌と免疫の研究が進展することも期待されるところだ。
また、近年蓄積されつつある「メタゲノム解析」との対応により、ヒトSFBの存在を検出することも可能になると予想されている。もしヒトSFBそのもの、もしくは同様の働きをするSFB様細菌の存在が確認されれば、ヒトにおいてもTh17細胞が関与するとされている感染防御機能の増強や自己免疫への対処なども進展することが期待されるところ。要は、SFBをコントロールすることでTh17細胞数を人為的に増加させて感染症の治療を行い、逆にその数を人為的に減少させることで、自己免疫疾患の治療につなげていくというわけだ。
さらに、そうした技術が確立されれば、従来のヒト遺伝子やタンパク質をターゲットとした疾患治療のほかに、腸内細菌をターゲットとした副作用を考慮しないで済む創薬や予防法の開発にもつながるとしている。それは、SFB以外の疾患に関する細菌種に対しても応用が可能になると考えられているとした。