東京大学は8月23日、胃がんを引き起こす決定的な要因とされるヘリコバクター・ピロリ(ピロリ菌)のがんタンパク質「CagA」が、ヒトタンパク質「プラグミン」の機能を競合阻害することを発見したことを明らかにした。発表を行ったのは、同大学大学院医学系研究科 病因・病理学専攻 微生物学講座教授の畠山昌則氏で、米国科学誌「米科学アカデミー紀要;Proceedings of the National Academy of Sciences of the United States of America」オンライン版に8月22日に掲載された。
ピロリ菌はヒトのがん発症に関わることが示された最初の細菌で、CagAはこれまでに知られている唯一の細菌由来タンパク質だ。しかし、ヒトのゲノムにはCagAと構造的に類似したタンパク質を作り出す遺伝子が存在していないのだが、今回の研究ではあえて「ヒト細胞にはグルタミン酸(E)-プロリン(P)-イソロイシン(I)-チロシン(Y)-アラニンの配列からなる「EPIYAモチーフ」(アミノ酸モチーフ)を持つタンパク質が存在し、CagAはそのタンパク質の機能を模倣することによりがんタンパク質として働く」と仮定。EPIYAモチーフを有するヒトタンパク質の単離・同定から研究は進められた。
最初に全米バイオテクノロジー情報センター(NCBI)に登録されたデータベースを解析し、ヒトプロテオーム(ヒトの全タンパク質カタログ)内には6種のEPIYAタンパク質が存在することを明らかにした。その6種類の内の1つが「プラグミン」である。
プラグミンはこれまで、神経細胞特異的に発現する「Rnd2」との結合を介して「RhoA」を活性化する「エフェクター分子」として機能することが報告されてはいたが、未解明な部分も多い。それでも、プラグミンのEPIYAモチーフは進化的に完全に保存されていることから、プラグミンの機能に必須な役割を担っていることなどは予想されていた。
次に判明したのが、プラグミンのEPIYAモチーフがヒト細胞内に存在するタンパク質リン酸化酵素によりチロシンリン酸化されること。さらに、チロシンリン酸化されたプラグミンが「Csk」(C-terminal Src kinase)と呼ばれる細胞質チロシンキナーゼに特異的に結合することも発見された。
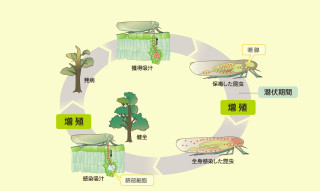
通常Cskは細胞質に存在するが、細胞膜近くまで移行することにより細胞の増殖・運動に深く関わる「Srcファミリーキナーゼ」(非受容体型チロシンキナーゼで、8種類のタンパク質の総称)を不活性化する働きをする。そこでCskの細胞内局在を解析したところ、プラグミンと結合したCskは細胞質に留まることが判明した。つまり、プラグミンはプラグミンはCskとの複合体形成を介して、Srcファミリーキナーゼの活性化を促すというわけである(画像1)。
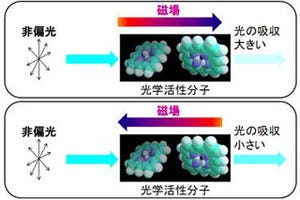
一方、ピロリ菌CagAもまたチロシンリン酸化されたEPIYAモチーフを介して、Cskと特異的に結合する機能を持つ。CagAと結合したCskは細胞膜に固定される結果、Srcファミリーキナーゼの活性は抑制されてしまう。すなわち、CagAはチロシンリン酸化EPIYAモチーフを介して、プラグミンの機能を競合阻害し、Srcファミリーキナーゼ活性制御機構を破綻させることが示されたのである(画像2)。
この結果から、ピロリ菌CagAを含む細菌性病原因子は、分子内にEPIYAモチーフを作り出すことによりプラグミンの機能を模倣することに成功した結果、さまざまな病原性/発がん性を獲得するに至ったと結論づけられたのである。
なお、近年の研究により、ピロリ菌以外の病原性細菌(病原性大腸菌、クラミジア、アナプラズマなど)が産生する「病原エフェクター分子」内にもEPIYAモチーフが存在することが判明。細菌性EPIYAエフェクターもまた、チロシンリン酸化することでさまざまな細胞内標的分子と特異的に結合する機能を得、細胞内シグナル伝達経路を異常に刺激あるいは抑制するのである。こうした事実から、EPIYAエフェクターは細菌の病原性発揮において、重要な役割を担うと考えられるようになった次第だ。ただし、細菌性EPIYAエフェクター分子種間には、EPIYAモチーフ以外に構造上の類似は存在しない点が謎。EPIYAモチーフがこれらの分子に独立して作り出された機構が、全く不明となっているのだ。