京都大学(京大)などによる研究グループは骨粗鬆症やがんの分子標的である「V型ATPase」の類似体と阻害剤(DCCD)の複合体構造をX線結晶構造解析により解明し、V型ATPaseを特異的に阻害するための分子機構を明らかにした。同研究結果は、V型ATPaseの機能異常により引き起こされる各種疾病の治療薬開発に繋がることが期待されるという。
同成果は京大 岩田想医学研究科教授、村田武士 千葉大学大学院理学研究科特任准教授(理化学研究所生命分子システム基盤研究領域客員研究員)、水谷健二 同研究員、横山茂之 理研生命分子システム基盤研究領域長、山登一郎 東京理科大学基礎工学研究科教授らによる共同研究によるもの、米国科学雑誌「米国科学アカデミー紀要(PNAS)」(電子版)にて公開された。
V型ATPaseは、ヒトなどの真核生物の多くの生体膜に存在し、水素イオンを運ぶことで膜内外のpHを調整する機能を持っているほか、骨の形成に関わる破骨細胞やがん細胞の膜にも存在し、骨粗鬆症やがん細胞の増殖・転移に関与していることが分かっている。そのため、V型ATPaseの分子メカニズムを知ることはこれら疾病の理解に繋がるとされ、V-ATPaseの阻害剤は治療薬として期待されている。
今回の研究ではV型ATPaseのイオン輸送メカニズムおよび、阻害剤による阻害機構を明らかにすることを目的に、阻害剤が結合したV型ATPaseローターリング部分の立体構造の解明を試みた。
V型ATPaseはATPのエネルギーを使って軸と膜内ローターリングを回転させ、これにより水素イオンを膜の逆側へと輸送するポンプとして機能している。一方、腸内連鎖球菌(Enterococcus hirae)にも哺乳類と良く似たV型ATPaseが存在し、水素イオンでなくナトリウムイオンを輸送する特徴を持っている。ナトリウムイオンは、X線結晶構造解析や放射性同位体を用いた実験において、水素イオンより検出しやすいという有利な点があるため、研究グループでは腸内連鎖球菌V型ATPaseの生化学的・構造生物学的研究を進めており、膜内のローターリング(Kサブユニット10個がリング状に結合したもの)が回転することによって隣接するIサブユニットとナトリウムイオンの受け渡しを行い、輸送していることを明らかにしていた。
|
|
|
図1 腸内連鎖球菌V型ATPaseの構造モデル腸内連鎖球菌V型ATPaseは9種類のタンパク質(F、I、K、E、C、G、A、B、D)からなる超分子複合体で、ATPの 加水分解のエネルギーによって、中央回転軸とローターリング(青い部分)を回転させ、ナトリウムイオンを細胞外へ排出する働きを持つ。ヒトのV型ATPaseも基本的な構造は酷似している |
今回の研究ではV型ATPaseの阻害剤として知られるDCCDの阻害機構について放射性同位体(22Na+)を用いて調べた結果、DCCDはローターリングからナトリウムイオンが解離した状態でのみ結合することが明らかになった。また、10カ所あるDCCD結合部位のうち1~2カ所でも結合するとV型ATPaseの活性を完全に阻害することも明らかとなったほか、DCCDが結合したローターリングのX線結晶構造解析にも成功した。
|
|
|
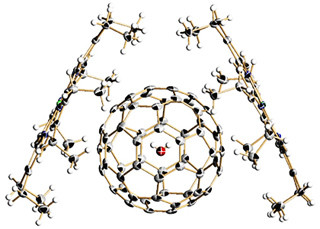
図2 DCCDが結合したローターリングのX線結晶構造。(A)は側面から見たローターリングの構造、(B)は上から見たローターリングの構造、(C-F)はナトリウムイオン(Na+)存在下(C、D)および非存在下(E、F)でのDCCD結合型ローターリングのナトリウム結合ポケットの構造 |
解析結果からは、DCCDはローターリングのナトリウム結合ポケットを塞ぐ役割をするグルタミン酸残基と共有結合していることが確認された。これにより、DCCDが結合することによってローターリングとIサブユニットとの界面で立体障害がおこり、回転が妨げられることにより機能阻害されることが示唆された。
さらに、ナトリウムイオン存在下/非存在下で結晶化を行うことにより、ナトリウム結合型(図21C/D)および非結合型(図2E/F)のローターリングの構造を得ることに成功し、これにより、イオン輸送におけるグルタミン酸残基の重要性や構造変化についての理解が大きく進み、V型ATPaseの詳細なイオン輸送メカニズムを提案することができたという。
今回の研究の結果により、V型ATPaseのローターリング部分に結合する阻害剤DCCDの阻害機構が明らかになったが、研究グループでは他に知られているV型ATPaseの阻害剤も同様にローターリングに結合し、阻害することが予想されることから、この知見により、V型ATPaseが関係する様々な疾病に対する薬剤の開発が進むものとの期待を示している。