理化学研究所(理研)は、Gタンパク質共役受容体を介してその作用を発現する塩基性タンパク質で白血球などの遊走を引き起こし、炎症の形成に関与する「ケモカイン」の1つ「CCL2タンパク質」が、マウス由来ES/iPS細胞の万能性を維持するために重要な役割を果たすことを発見した。
同成果は、理研オミックス基盤研究領域(理研OSC) LSA要素技術開発グループLSA 要素技術開発ユニットの鈴木治和プロジェクトディレクター、長谷川由紀研究員らの研究グループの成果で、米国の科学雑誌「Stem Cells」(オンライン版)に掲載された。
万能細胞であるES細胞は、生命の萌芽ともいえる発生初期の胚を使うことから、倫理的な問題が指摘されている。一方、iPS細胞は、理論的には胚を含むすべての細胞から作製することが可能となるため、倫理的な問題を解決するだけでなく、今後より重要となる生命発生に関する基礎研究から再生医療といった応用研究まで、幅広い分野の研究基盤となることが期待されており、2006年8月に、京都大学山中伸弥教授を中心とする研究グループが、マウスのiPS細胞作製に関する論文を米誌「Cell」に掲載して以来、具体的な再生医療へ向けて、注目が高まっている。
一般的に、こうしたES/iPS細胞の培養には、繊維芽細胞などのフィーダー細胞を使用する培養法が利用されているが、近年、フィーダー細胞を使用しない培養方法も報告されている。中でもマウス由来ES/iPS細胞では、分化抑制因子としてLIFタンパク質を用いた培養法が報告されており、フィーダー細胞を使用しなくても万能性の維持が実現されている。しかし、ヒト由来ES/iPS細胞では、万能性の維持と向上に有効かつ簡便で安価な手段は確立されていない。
万能性の維持を保つことができないと、目的の細胞への分化誘導ができない状態となり、再生医療への転用が不可能となるほか、フィーダー細胞やヒト由来ES/iPS細胞におけるフィーダー細胞なしの培養法は、煩雑な手間を必要とし、高価となるため、簡単、高品質、高効率で万能性の維持を保つ技術開発が求められていた。
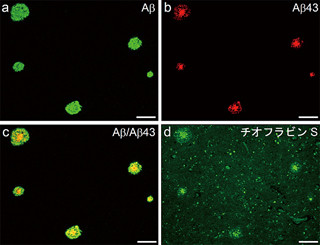
今回、研究グループは、ES/iPS細胞の万能性について評価するために、万能性の指標であるNanog遺伝子の下流に蛍光タンパク質GFPを挿入したマウス由来のNanog-GFP iPS細胞を作製した。同細胞は、万能性を維持した状態では緑色を発光するため、その強度を計測して万能性を定量的に評価することができるという特長がある。

|
|
図1 マウスNanog-GFP iPS 細胞による万能性の評価 |
また、通常の細胞培養条件下でフィーダー細胞が産出するLIFタンパク質の濃度をマイクロアレイ法で調べたところ、この濃度が、ES/iPS細胞の万能性を維持するのに推奨される濃度(1000μ/ml)の40分の1ほどしかないことが分かった。
そこで、万能性を維持するLIFタンパク質以外の因子を同定するために、作製したNanog-GFP iPS細胞を、フィーダー細胞がある場合とない場合で培養し、その蛍光強度と遺伝子発現の様子を比較した。その結果、17の遺伝子で発現に明らかな差があり、フィーダー細胞なしの状態でこれらの遺伝子を過剰発現させると、細胞を遊走させる活性を持つことで知られているCCL2タンパク質だけが、万能性の維持に重要な転写因子であるSox2、Klf4、Tbx3、Nanog 遺伝子の発現を亢進させることを見いだした。
一方、CCL2タンパク質の発現量を減少させる遺伝子操作を施した細胞を用いた実験では、これら転写因子の発現が減少することも判明したほか、市販のCCL2タンパク質を、フィーダー細胞なしのiPS細胞に、異なるLIFタンパク質の濃度で添加して、その万能性を調べたところ、すべての濃度で万能性状態が維持されていることが分かった。

|
|
図3 各LIF濃度でのCCL2タンパク質添加によるiPS細胞の万能性の向上。CCL2タンパク質のiPS細胞に対する万能性維持能を、各LIFタンパク質の濃度でGFP発現を指標として調べたところ、フィーダー細胞が分泌する濃度と同等の25μ/mlでは、CCL2タンパク質の添加により、iPS細胞の万能性維持が劇的に改善されたほか、同様の効果はES細胞でも確認された |
次に、CCL2タンパク質が作用するシグナル伝達経路を調べるために、LIFタンパク質のシグナル伝達に関わる3 つの経路の因子(Stat3、MAPK、Akt)のリン酸化をウエスタンブロッティング法で確認したところ、CCL2タンパク質が、悪性腫瘍形成初期にしばしば制御不全となるLIF シグナル伝達経路の1つ「Jak-Stat(ジャックスタット)パスウェイ」を活性化することを見いだした。
従来からCCL2タンパク質は、他細胞を制御する働きが報告されていたが、iPS細胞の万能性を維持する機能を持つことを立証したのは今回が初めてという。
今回の成果により、従来の技術では不可能であったヒト由来のES/iPS細胞を、CCL2タンパク質によって万能性を維持したまま培養できる可能性が見いだされた。また、同成果は多くの研究者が入手困難な実験用試料を容易に作製する技術開発に貢献することが期待されると研究グループでは説明しており、理研OSCでは、このCCL2タンパク質に関連する知見を公表することで、再生医療への基礎作りに役立てていくとしている。