理化学研究所(理研)と東京理科大学(理科大)は7月15日、インフルエンザウイルスに対する免疫反応がワクチン接種とウイルス感染では異なることを発見し、経鼻感染の方がワクチン接種よりも質の高い「広域中和抗体」が産生されるメカニズムの一端を明らかにしたと発表した。
同成果は、理研 生命医科学研究センター サイトカイン制御研究チームの久保允人チームリーダー(理科大 生命医科学研究所 教授兼務)のほか、理科大、国立感染症研究所、慶應義塾大学、かずさDNA研究所の総勢16名の研究者が参加した共同研究チームによるもの。詳細は、英オンライン科学誌「Nature Communications」に掲載された。
現在、インフルエンザの予防のために広く使用されている「不活化ワクチン」は、ホルマリン処理などによって感染性を消失させたウイルス粒子が使用されている。そのため、そのワクチンに使用したインフルエンザウイルス株に対しての有効性は高いものの、新しく現れた構造の異なる新型株に対しては有効性が低いといわれている。
それに対し、不活化ワクチンよりも安全性の面でリスクが高いが、変異によって弱毒化させたウイルスを感染させて中和抗体を作る「弱毒生ワクチン」という手法もある。不活化されていないため、ヒトでの調査研究から、弱毒生ワクチンの経鼻投与は、新型株に対しても有効性があることが示されている。
弱毒生ワクチンでは、ワクチンに用いられたウイルス株とは異なる株による感染に対しても防御が可能な、質の高い「広域中和抗体」が産生される可能性があることが理由と考えられている。ただし、そのメカニズムについてはよくわかっていなかったという。
そこで研究チームは今回、不活化ワクチン接種と弱毒生ワクチンを模倣した経鼻ウイルス感染で産生される抗体の質的・量的な違いと免疫応答の違いを、マウスを用いた実験で調べることにしたという。
研究では、不活化ワクチン接種では産生されず、経鼻ウイルス感染によってのみ産生される広域中和抗体を解析できるマウスモデルが用いられた。まず2009年パンデミックインフルエンザウイルス株(ブタ由来H1N1亜型、以降パンデミック株)から作製された不活化ワクチンを接種させたマウス、あるいは生きたパンデミック株を感染させたマウスから抗体をそれぞれ分離。その2種類の抗体をそれぞれ別のマウスに移入したのち、パンデミック株とは異なる季節性インフルエンザウイルス株(以降、季節性ウイルス株)が感染させられた。
実験の結果、不活化パンデミック株ワクチンを接種させたマウスの抗体が移入されたマウスは、季節性ウイルス株の感染によって死亡してしまったが、パンデミック株を感染させたマウスの抗体が移入されたマウスでは、季節性ウイルス株の感染が防御されることが確認されたという。
-

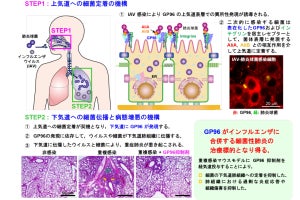
不活化ワクチン接種マウスとウイルス感染のマウスにおける感染の違い。(上段)不活化パンデミック株ワクチンを接種したマウスの抗体が移入されたマウスは、季節性インフルエンザウイルス株の感染によって死亡してしまった。(下段)生きたパンデミック株を感染させたマウスの抗体が移入されたマウスは、季節性インフルエンザウイルス株の感染から防御された。(出所:理研Webサイト)
これは、不活化パンデミック株ワクチンを接種させたマウスでは、ワクチンに使用されたウイルス株に対抗できる抗体しか産生されなかったからだという。それに対し、パンデミック株を実際に感染させたマウスでは、構造の異なる季節性ウイルス株に対しても対抗できる広域中和抗体が産生されたことを示しているとした。
次に、生きたウイルスの感染が広域中和抗体を産生する原因として、ウイルスの侵入経路とウイルスの複製の2つが想定され、その上で侵入経路が経鼻に統一され、ウイルスを複製しないマウス(Tmprss2欠損マウス)についての調査が行われた。その結果、Tmprss2欠損マウスでは、生きたパンデミック株ウイルスを感染させても広域中和抗体は産生されず、その抗体が移入されたマウスは季節性ウイルス株に対する抵抗性を示さなかったという。
そして、パンデミック株に感染させた野生型マウスの抗体産生B細胞が解析され、パンデミック株と季節性ウイルス株に共通するエピトープ(抗原決定基)を認識する抗体が産生されていることが明らかとなった。このことから、経鼻から生きたウイルスが体内に侵入するとB細胞の増殖に伴って共通エピトープが形成される過程が、広域中和抗体が産生されるメカニズムであることが示されたとした。
さらに、ウイルス複製がどのように広域中和抗体の産生につながるのかを解明するため、免疫器官のリンパ節、特にB細胞の選別に重要な働きをする「胚中心」と、B細胞の抗体産生を助ける働きをする「濾胞性ヘルパーT細胞(TFH細胞)」に着目することにしたという。胚中心とTFH細胞持たない遺伝子改変マウスが作製され、生きたパンデミック株が感染させられた。すると、広域中和抗体は産生されなかったとした。
TFH細胞は、インターロイキン-4(IL-4)やIL-21などのサイトカイン(細胞間でやり取りされる多様な生理活性を持つタンパク質の1種)を産生することで、B細胞の機能を助けることが知られている。ウイルスが感染した野生型マウスのリンパ節ではTFH細胞の活性化が確認された一方で、B細胞の分化増殖因子であるIL-4を欠損したマウスでは、胚中心の形成不全に伴い広域中和抗体の産生が著しく低下していることが判明した。
これらの結果から、TFH細胞から産生されるIL-4は、胚中心内のB細胞の増殖をコントロールすることで、ウイルス感染時に産生される抗体の多様性を広げる重要な働きをすることが明らかになったほか、生きたウイルスの経鼻感染は、TFH細胞を活性化することでB細胞の増殖に必要なIL-4を誘導し、リンパ節内の胚中心においてB細胞の中からウイルス株に共通したエピトープを認識するB細胞の選別が進められ、それが広域中和抗体の産生へとつながることが確認されたともしている。
-

広域中和抗体の産生メカニズム。ウイルス感染では、ウイルス複製に伴って活性化されたTFH細胞からのIL-4の働きで、胚中心においてB細胞の増殖が促進される。増殖したB細胞の中から、ウイルス株に共通したエピトープを認識するB細胞の選別が進められ、これが広域中和抗体の産生へとつながることが明らかとなった (出所:理研Webサイト)
今回の成果を受けて研究チームでは、新型インフルエンザに対抗するためのユニバーサルワクチンの開発に有用な基礎データを提供することができたとするほか、今後の抗ウイルスワクチン研究において大きな意義を持つと考えられるとしている。