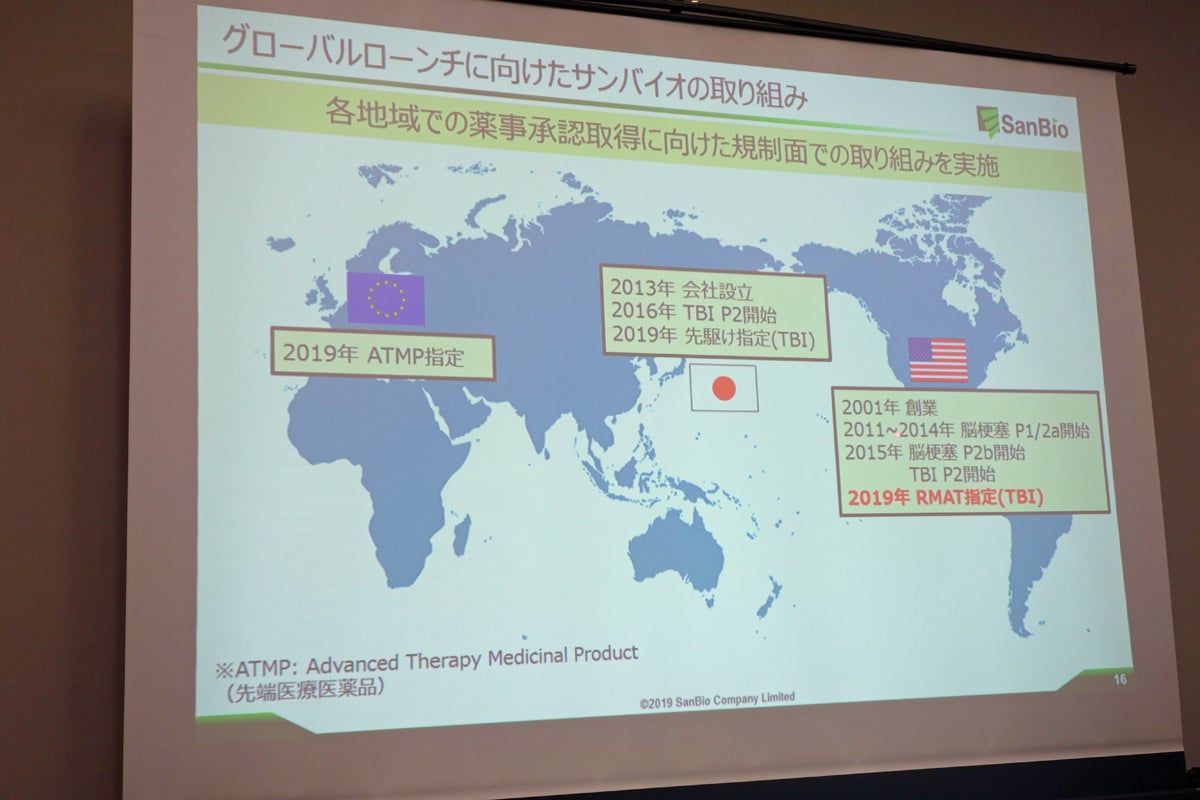
サンバイオは9月19日、同社グループが開発を進めている外傷性脳損傷(Transmatic Brain Injury:TBI)を対象疾患とした再生細胞薬「SB623」が、米国食品医薬品局(FDA)の「RMAT(Regenerative Medicine Advanced Therapy)」の対象品目指定を受けることが決定したことを明らかにした。
RMATは、米国の「21st Century Cures Act(21世紀治療法)」のもとに設立され、アンメットメディカルニーズがある重篤な疾患に対する再生医療であり、臨床試験において一定の効果を示した治療法を対象として、FDAが指定を行うもの。すでに同社は2019年4月に日本の厚生労働省からも、対象疾患の重篤性など、一定の要件を満たす画期的な新薬などについて、開発の早期段階から対象品目に指定し、薬事承認に関する相談・審査で優先的な取扱いをすることで、承認審査の期間を短縮することを目的とする「先駆け審査指定制度」の対象品目として指定を受けているほか、同4月には欧州医薬品庁(EMA)から、先端医療医薬品(ATMP)の指定も受けており、これで日欧に加え、米国における薬事承認取得に向けて一歩前進したこととなる。
サンバイオ代表取締役社長の森敬太氏は、「今後、日本における申請を今期(2020年1月期)中に行い、承認ならびに販売を来期(2021年1月期)を目指す」としており、2020年中に製薬企業への脱皮を図ると意気込みを語る。
また、同社グループ会社である米国SanBioの辻村明広CEOは、「日米欧、および中国、オーストラリアでTBI患者は推定で2000万人弱、脳梗塞は推定で2000万人強と見られるが、中でも慢性期のそうした疾患に対する治療オプションはほとんどなく、多くの患者、医師ともに新たな治療オプションを心待ちにしている」とし、競合製品がない当該分野において、日本を皮切りに、世界中のアンメットメディカルニーズに対応していくことを目指すとした。
なお、グローバル展開として同社は、2021年1月期末(2021年1月)までにフェーズ3臨床試験の開始を計画しているとするが、その具体的な試験デザインや開発内容は現在検討中としている。また、TBIでの実績を積み重ねていく一方で、脳梗塞のほか、アルツハイマー病やパーキンソン病、加齢黄班変性(ドライ型)など、複数の疾患にも適用可能性があるともしており、グローバル展開と併せて、適用範囲の拡大も順次行っていければ、としている。